题目内容
19.在1.01×105Pa、150℃时,将3LC2H4、1LC2H2、1LC2H6与20LO2混合并点燃,完全反应后,恢复至原来状态,气体的体积是( )| A. | 10L | B. | 15L | C. | 25L | D. | 30L |
分析 150℃,水为气体,燃烧的化学方程式为C2H4+2O2$\stackrel{点燃}{→}$CO2+2H2O(g)反应前后气体的体积不变,3L乙烯只消耗6L氧气;
2C2H2+5O2$\stackrel{点燃}{→}$4CO2+2H2O(g),1L C2H2燃烧消耗2.5L氧气;
2C2H6+7O2$\stackrel{点燃}{→}$4CO2+6H2O(g),1L C2H6燃烧消耗3.5L氧气,
可知氧气过量,等体积的C2H2、C2H6混合平均组成为C2H4,以此来解答.
解答 解:由C2H4+2O2$\stackrel{点燃}{→}$CO2+2H2O(g)、2C2H2+5O2$\stackrel{点燃}{→}$4CO2+2H2O(g)、2C2H6+7O2$\stackrel{点燃}{→}$4CO2+6H2O(g)可知,氧气足量,150℃,水为气体,
等体积的C2H2、C2H6混合平均组成为C2H4,乙烯燃烧前后气体的体积不变,
则完全反应后的混合气体恢复到原状态时,其体积为3L+1L+1L+20L=25L,
故选C.
点评 本题考查化学反应方程式的计算,为高频考点,把握燃烧规律及混合气体的平均组成为C2H4是解答的关键,侧重分析与计算能力的考查,注意平均组成法的应用,题目难度不大.

练习册系列答案
相关题目
14.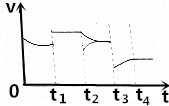 如图是反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的正反应速率随时间的变化图象,在t1时反应达到平衡状态,然后改变一个条件,v正的变化如图所示,则下列说法正确的是( )
如图是反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的正反应速率随时间的变化图象,在t1时反应达到平衡状态,然后改变一个条件,v正的变化如图所示,则下列说法正确的是( )
 如图是反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的正反应速率随时间的变化图象,在t1时反应达到平衡状态,然后改变一个条件,v正的变化如图所示,则下列说法正确的是( )
如图是反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的正反应速率随时间的变化图象,在t1时反应达到平衡状态,然后改变一个条件,v正的变化如图所示,则下列说法正确的是( )| A. | t1时改变的条件是增大压强,且平衡没有移动 | |
| B. | t2时改变的条件时减小甲醇的浓度,且平衡正向移动 | |
| C. | t2时改变的条件是增大了氢气的浓度,且平衡正向移动 | |
| D. | t3是改变的条件是升高温度,且平衡正向移动 |
14.下列关于苯酚的说法正确的是( )
| A. | 常温下,苯酚易溶于水 | |
| B. | 苯酚俗称石炭酸,具有微弱的酸性,能与碳酸钠溶液反应 | |
| C. | 纯净的苯酚是粉红色晶体 | |
| D. | 洒落皮肤上的苯酚可以用氢氧化钠稀溶液洗涤 |
4.下列除去杂质(括号内为杂质)的方法中,正确的是( )
| A. | 乙烷(乙炔):将混合气体通过酸性高锰酸钾溶液,洗气除去乙烷中的乙炔气体 | |
| B. | 苯(苯酚):向混合液中加入适量的浓溴水,过滤,除去苯中的少量苯酚 | |
| C. | 酒精(水):向含水酒精中加入生石灰,蒸馏,得到无水酒精 | |
| D. | 硝基苯(NO2):向溶有杂质的硝基苯加入一定量的浓氢氧化钠溶液,振荡,分液可除去中溶解的NO2 |
8.下列液体温度均处在25℃,有关叙述正确的是( )
| A. | 某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 将1 L 0.1 mol•L-1的Ba(OH)2溶液稀释为2 L,pH=12 | |
| D. | pH=8的NaOH溶液稀释100倍,其pH=6 |
9.与CO32-不是等电子体的是( )
| A. | SO3 | B. | BF3 | C. | NO3- | D. | PCl3 |
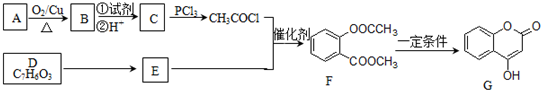


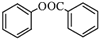 )的合成路线流程图(无机原料任用).
)的合成路线流程图(无机原料任用).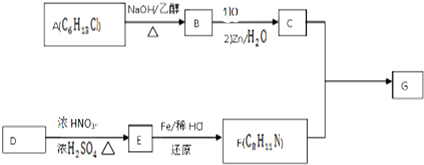
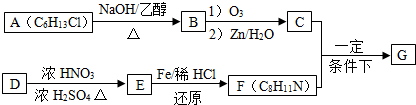
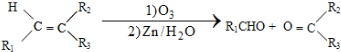
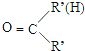 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$  +H2O.
+H2O. .
. .(写出其中的一种的结构简式).
.(写出其中的一种的结构简式). $\stackrel{反应条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件下}^{C}$J$\stackrel{还原}{→}$
$\stackrel{反应条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件下}^{C}$J$\stackrel{还原}{→}$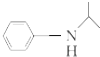
 .
.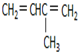 2-甲基-1,3-丁二烯;
2-甲基-1,3-丁二烯;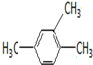 1,2,4-三甲基苯;
1,2,4-三甲基苯;