题目内容
已知1~18号元素的离子aXm+、bY n+、cZP-、dWk-都具有相同的电子层结构,下列关系正确是( )
| A、若P>K,则其氢化物的稳定性HKW<HPZ |
| B、若m>n,则碱性 X(OH)m>Y(OH)n |
| C、若半径aXm+>bY n+,则a<b |
| D、若半径aXm+>bY n+,则X的单质一定能从含Yn+的盐溶液中置换出Y |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:1~18号元素的离子aXm+、bY n+、cZP-、dWk-都具有相同的电子层结构,X、Y为金属,处于第三周期,Z、W为非金属性,处于第二周期,
A.若P>K,则原子序数W>Z,同周期随原子序数增大非金属性增强,非金属性越强,氢化物越稳定;
B.若m>n,则原子序数X>Y,同周期随原子序数增大金属性减弱,金属性越强,最高价氧化物对应水化物的碱性越强;
C.电子层结构相同,核电荷数越大离子半径越小;
D.若X为Na,X的单质不能能从含Yn+的盐溶液中置换出Y.
A.若P>K,则原子序数W>Z,同周期随原子序数增大非金属性增强,非金属性越强,氢化物越稳定;
B.若m>n,则原子序数X>Y,同周期随原子序数增大金属性减弱,金属性越强,最高价氧化物对应水化物的碱性越强;
C.电子层结构相同,核电荷数越大离子半径越小;
D.若X为Na,X的单质不能能从含Yn+的盐溶液中置换出Y.
解答:
解:1~18号元素的离子aXm+、bY n+、cZP-、dWk-都具有相同的电子层结构,X、Y为金属,处于第三周期,Z、W为非金属性,处于第二周期,
A.若P>K,则原子序数W>Z,同周期随原子序数增大非金属性增强,故氢化物越稳定HKW>HPZ,故A错误;
B.若m>n,则原子序数X>Y,同周期随原子序数增大金属性减弱,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性X(OH)m<Y(OH)n,故B错误;
C.离子半径aXm+>bY n+,离子电子层结构相同,核电荷数越大离子半径越小,则a<b,故C正确;
D.若X为Na,X的单质不能能从含Yn+的盐溶液中置换出Y,故D错误,
故选C.
A.若P>K,则原子序数W>Z,同周期随原子序数增大非金属性增强,故氢化物越稳定HKW>HPZ,故A错误;
B.若m>n,则原子序数X>Y,同周期随原子序数增大金属性减弱,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性X(OH)m<Y(OH)n,故B错误;
C.离子半径aXm+>bY n+,离子电子层结构相同,核电荷数越大离子半径越小,则a<b,故C正确;
D.若X为Na,X的单质不能能从含Yn+的盐溶液中置换出Y,故D错误,
故选C.
点评:本题考查结构与位置关系、元素周期律等,难度中等,根据电荷与核外电子排布相同推断元素在周期表中的位置是关键.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
下列有关化学用语以及化学基本概念的表述中正确的一组是( )
A、过氧乙酸( )与羟基乙酸( )与羟基乙酸( )所含官能团相同,两者互为同分异构体 )所含官能团相同,两者互为同分异构体 |
| B、日本福岛核电站泄露的放射性核素 53 131I和 55 137Cs,前者比后者少4个中子 |
| C、淀粉和纤维素不是同分异构体,但属于同系物 |
| D、糖类、油脂、蛋白质都是由C、H、O三种元素组成的 |
下列有关反应的离子方程式正确的是( )
| A、向Fe(NO3)2稀溶液中滴入NaHSO4溶液:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O |
| B、向漂白粉溶液中不断通入CO2:Ca2++CO2+H2O=CaCO3↓+2H+ |
| C、向AlCl3溶液中滴加足量的NH3?H2O:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| D、SiO2与NaOH溶液反应:SiO2+2OH-=SiO32-+H2↑ |
下列各组离子在溶液中能大量共存的是( )
| A、CH3COO-、Cl-、K+、H+ |
| B、SO42-、Cl-、Ba2+、Na+ |
| C、Cl-、NO3-、NH4+、Na+ |
| D、HCO3-、NO3-、Al3+、K+ |
将8g铁片放入100mL CuSO4溶液中,Cu2+全部被置换后,取出附有铜的铁片洗涤、干燥、称重,其质量变为8.2g,则原溶液中CuSO4的物质的量浓度是( )
| A、0.125 mol/L |
| B、0.175 mol/L |
| C、0.25 mol/L |
| D、0.5 mol/L |
关于如图装置的叙述,不正确的是( )
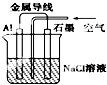

| A、铝是负极,铝片上析出无色气体 |
| B、石墨是正极,石墨棒上析出黄绿色气体 |
| C、溶液中两电极间产生白色沉淀 |
| D、溶液中Na+向石墨方向移动 |
一块表面已被氧化为Na2O的钠块17.0g,将其投入100g水中,产生H2 0.2g,则被氧化的钠是( )
| A、4.6g | B、12.4g |
| C、6.2g | D、9.2g |
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,T元素为地壳中含量最多的金属元素.请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,T元素为地壳中含量最多的金属元素.请回答下列问题: