题目内容
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,T元素为地壳中含量最多的金属元素.请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,T元素为地壳中含量最多的金属元素.请回答下列问题:(1)T的离子结构示意图为
(2)元素的非金属性为:Q
(3)R元素的氢化物的电子式为
(4)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为
(5)0.5mol Q单质与0.5mol 水蒸气恰好反应生成0.5mol H2时,需要吸收65.75kJ的热量,请写出该反应的热化学方程式
(6)T的单质与W的最高价氧化物的水化物浓溶液共热,一段时间后发现固态表面有大量无色气泡冒出,同时还异常地嗅到了一股刺激性气味.你猜想该气体是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:T所处的周期序数与主族序数相等,T元素为地壳中含量最多的金属元素,则T为Al,由短周期元素Q、R、T、W在元素周期表中的位置可知,Q为C、R为N、W为S,
(1)铝离子质子数为13,核外电子数为10,有2个电子层,各层电子数为2、8;
(2)同周期自左而右非金属性增强;
(3)R元素的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对;
(4)硫与浓硫酸反应生成二氧化硫与水;
(5)发生反应:C(s)+H2O(g)═CO(g)+H2(g),计算1mol碳完全反应吸收的热量,注明物质的聚集状态与反应热,据此书写热化学方程式;
(6)Al与浓硫酸在加热条件下生成的气体具有刺激性气味,该气体为二氧化硫,可以根据二氧化硫能使品红溶液褪色进行验证.
(1)铝离子质子数为13,核外电子数为10,有2个电子层,各层电子数为2、8;
(2)同周期自左而右非金属性增强;
(3)R元素的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对;
(4)硫与浓硫酸反应生成二氧化硫与水;
(5)发生反应:C(s)+H2O(g)═CO(g)+H2(g),计算1mol碳完全反应吸收的热量,注明物质的聚集状态与反应热,据此书写热化学方程式;
(6)Al与浓硫酸在加热条件下生成的气体具有刺激性气味,该气体为二氧化硫,可以根据二氧化硫能使品红溶液褪色进行验证.
解答:
解:T所处的周期序数与主族序数相等,T元素为地壳中含量最多的金属元素,则T为Al,由短周期元素Q、R、T、W在元素周期表中的位置可知,Q为C、R为N、W为S,
(1)铝离子质子数为13,核外电子数为10,有2个电子层,各层电子数为2、8,离子结构示意图为: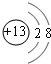 ,故答案为:
,故答案为: ;
;
(2)Q、R同周期,自左而右非金属性增强,故非金属性Q<R,故答案为:<;
(3)R元素的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对,其电子式为: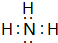 ,故答案为:
,故答案为: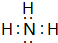 ;
;
(4)硫与浓硫酸在加热条件下反应生成二氧化硫与水,反应方程式为:S+2H2SO4(浓)
3SO2↑+2H2O,故答案为:S+2H2SO4(浓)
3SO2↑+2H2O;
(5)1mol碳完全反应吸收的热量为65.75kJ×2=131.5kJ,该反应热化学方程式为:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJ?mol-1,故答案为:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJ?mol-1;
(6)Al与浓硫酸在加热条件下生成的气体具有刺激性气味,该气体为二氧化硫,检验二氧化硫的实验方案为:将生成的气体通入品红溶液,若溶液褪色,则证明该气体为二氧化硫,故答案为:SO2;将生成的气体通入品红溶液,若溶液褪色,则证明该气体为二氧化硫.
(1)铝离子质子数为13,核外电子数为10,有2个电子层,各层电子数为2、8,离子结构示意图为:
 ,故答案为:
,故答案为: ;
;(2)Q、R同周期,自左而右非金属性增强,故非金属性Q<R,故答案为:<;
(3)R元素的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对,其电子式为:
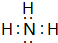 ,故答案为:
,故答案为: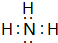 ;
;(4)硫与浓硫酸在加热条件下反应生成二氧化硫与水,反应方程式为:S+2H2SO4(浓)
| ||
| ||
(5)1mol碳完全反应吸收的热量为65.75kJ×2=131.5kJ,该反应热化学方程式为:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJ?mol-1,故答案为:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJ?mol-1;
(6)Al与浓硫酸在加热条件下生成的气体具有刺激性气味,该气体为二氧化硫,检验二氧化硫的实验方案为:将生成的气体通入品红溶液,若溶液褪色,则证明该气体为二氧化硫,故答案为:SO2;将生成的气体通入品红溶液,若溶液褪色,则证明该气体为二氧化硫.
点评:本题考查元素周期表与周期律的综合应用,难度不大,侧重对化学用语的考查,注意掌握电子式与热化学方程式的书写.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 若要在铜片上镀银时,下列叙述中错误的是( )
若要在铜片上镀银时,下列叙述中错误的是( )①将铜片接在电源的正极 ②将银片接在电源的正极 ③在铜片上发生的反应是:Ag++e-═Ag ④在银片上发生的反应是:4OH--4e-═O2+2H2O ⑤可用CuSO4溶液作电解质溶液 ⑥可用AgNO3溶液作电解质溶液.
| A、①③⑥ | B、②③⑥ |
| C、①④⑤ | D、②③④⑥ |
下列各离子组在溶液中能共存且通入括号中相应气体后,仍能大量存在的是( )
| A、Na+、Ba2+、HSO3-、I-(氯气) |
| B、Ca2+、NO3-、Na+、Cl-(二氧化硫) |
| C、Fe3+、SO42-、CO32-、NO3-(氨气) |
| D、Na+、K+、HCO3-、Cl-(二氧化碳) |
已知1~18号元素的离子aXm+、bY n+、cZP-、dWk-都具有相同的电子层结构,下列关系正确是( )
| A、若P>K,则其氢化物的稳定性HKW<HPZ |
| B、若m>n,则碱性 X(OH)m>Y(OH)n |
| C、若半径aXm+>bY n+,则a<b |
| D、若半径aXm+>bY n+,则X的单质一定能从含Yn+的盐溶液中置换出Y |
下列实验方案的设计中,可行的是( )
| A、向某溶液中滴加BaCl2溶液,出现白色沉淀,再加足量稀HCl,若白色沉淀不溶解,则说明原溶液中一定含SO42- |
| B、某气体通入澄清石灰水溶液能使其变浑浊,该气体一定是CO2 |
| C、向某盐溶液中滴加NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,则原溶液含NH4+ |
| D、某气体通入滴有紫色石蕊试剂的水中,若水变为红色,该气体一定是SO2 |
 进入冬季,郑州市频现雾霾天气,给人们的出行和生活带来极大的不便和危害,人们“谈霾色变”.目前郑州市汽车占有量达230万辆,汽车尾气污染是引起雾霾的主要因素之一.
进入冬季,郑州市频现雾霾天气,给人们的出行和生活带来极大的不便和危害,人们“谈霾色变”.目前郑州市汽车占有量达230万辆,汽车尾气污染是引起雾霾的主要因素之一.