��Ŀ����
7�� ��1��������Ԫ��A��B��C��D��E��ԭ��������������AΪ�뾶��С��ԭ�ӣ�A��Cͬ�壬B��Dͬ�壬C���Ӻ�B���Ӿ�����ͬ�ĵ��Ӳ�ṹ��A��B�γɵĻ�������ˮ�гʼ��ԣ�C��E�γɵĻ�������ˮ�г����ԣ���A��E�γɵĻ�������A��B�γɵĻ����ﷴӦ�ɲ������̣��ش��������⣺
��1��������Ԫ��A��B��C��D��E��ԭ��������������AΪ�뾶��С��ԭ�ӣ�A��Cͬ�壬B��Dͬ�壬C���Ӻ�B���Ӿ�����ͬ�ĵ��Ӳ�ṹ��A��B�γɵĻ�������ˮ�гʼ��ԣ�C��E�γɵĻ�������ˮ�г����ԣ���A��E�γɵĻ�������A��B�γɵĻ����ﷴӦ�ɲ������̣��ش��������⣺��C��Ԫ�ط���Na���ǽ�������ǿ��Ԫ����Cl����Ԫ�ط��ţ�����������ӵ����ӽṹʾ��ͼΪ
 ��
������A��B��D��E���γɵĹ����ͻ������У����ȶ���������H3P���û�ѧʽ��ʾ����
��2��A��B��C��D��E��F�������ʵ�ת����ϵ��ͼ��ʾ����Ӧ�����Ͳ��ֲ���δ���������ش��������⣺
����AΪ�����ڽ������ʣ�DΪ�����ڷǽ������ʣ�������Ԫ�ص�ԭ������A��D��2��������Ԫ�ص�ԭ������������D��A��2����F��Ũ��Һ��A��D��Ӧ���к���ɫ�������ɣ���A��ԭ�ӽṹʾ��ͼΪ
 ����Ӧ�ܵĻ�ѧ����ʽΪC+4HNO3��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CO2+4NO2��+2H2O��
����Ӧ�ܵĻ�ѧ����ʽΪC+4HNO3��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CO2+4NO2��+2H2O������A��D��F���Ƕ����ڷǽ���Ԫ�ص��ʣ���A��D����Ԫ��ͬ���壬A��F����Ԫ��ͬ���ڣ���D������������Ϊ�������ӵ�һ�룬��Ӧ�ٵĻ�ѧ����ʽΪ2C+SiO2$\frac{\underline{\;����\;}}{\;}$Si+2CO������״����3.36L����E�뺬��������10.0g����Һ��ַ�Ӧ��������Һ�����ʳɷ�Na2CO2��0.1molΪNaHCO3��0.05mol��д����ѧʽ�Ͷ�Ӧ�����ʵ�������
���� ��1��������Ԫ��A��B��C��D��E��ԭ��������������AΪ�뾶��С��ԭ�ӣ���AΪHԪ�أ�A��Cͬ�壬���ԭ��������С��֪CΪNaԪ�أ�C���Ӻ�B���Ӿ�����ͬ�ĵ��Ӳ�ṹ����Bλ�ڵڶ����ڣ�B��Dͬ�壬��Dλ�ڵ������ڣ�A��B�γɵĻ�������ˮ�гʼ��ԣ��û�����Ϊ��������BΪNԪ�أ�B��Dͬ�壬��DΪP��A��E�γɵĻ�������A��B�γɵĻ����ﷴӦ�ɲ������̣���A��E�γɵĻ�����ΪHCl����EΪClԪ�أ����㡰C��E�γɵĻ�������ˮ�г����ԡ����ݴ˽��н��
��2������AΪ�������ڵĽ������ʣ�DΪ�����ڷǽ������ʣ�������Ԫ�ص�ԭ������A��D��2������Aԭ��������ż��������Ԫ�ص�ԭ������������D��A��2������A��Mg��D��CԪ�أ�F��Ũ��Һ��A��D��Ӧ���к���ɫ�������ɣ�����ɫ������NO2����F��HNO3��C��HNO3Ũ��Һ��Ӧ����CO2��NO2��H2O��B�ܺ�Mg��Ӧ����̼���ʣ���B��CO2��C��MgO��MgO�����ᷴӦ����Mg��NO3��2��H2O��Mg�����ᷴӦ����Mg��NO3��2����E��Mg��NO3��2��
��A��D��F���Ƕ����ڷǽ���Ԫ�ص��ʣ���A��D����Ԫ��ͬ���壬B���������ά����BΪSiO2��A��F����Ԫ��ͬ���ڣ���AΪC��DΪSi��FΪO2������ת����ϵ��CΪCO��EΪCO2����Ӧ��ΪC���������ķ�Ӧ���ݴ˴��⣮
��� �⣺��1��������Ԫ��A��B��C��D��E��ԭ��������������AΪ�뾶��С��ԭ�ӣ���AΪHԪ�أ�A��Cͬ�壬���ԭ��������С��֪CΪNaԪ�أ�C���Ӻ�B���Ӿ�����ͬ�ĵ��Ӳ�ṹ����Bλ�ڵڶ����ڣ�B��Dͬ�壬��Dλ�ڵ������ڣ�A��B�γɵĻ�������ˮ�гʼ��ԣ��û�����Ϊ��������BΪNԪ�أ�B��Dͬ�壬��DΪP��A��E�γɵĻ�������A��B�γɵĻ����ﷴӦ�ɲ������̣���A��E�γɵĻ�����ΪHCl����EΪClԪ�أ����㡰C��E�γɵĻ�������ˮ�г����ԡ���
�ٸ��ݷ�����֪��CΪNaԪ�أ�
ͬһ����Ԫ�أ�Ԫ�طǽ���������ԭ�������������ǿ��ͬһ����Ԫ�أ�Ԫ�طǽ���������ԭ������������������⼸��Ԫ���зǽ�������ǿ����ClԪ�أ������ӵĺ˵����Ϊ17�������������Ϊ18�������ӽṹʾ��ͼΪ ��
��
�ʴ�Ϊ��Na��Cl�� ��
��
��A��E�γɵĻ�������HCl��A��B�γɵĻ������ǰ�����A��D�γɵĻ��������⣬�ǽ�����Խǿ����Ӧ�⻯��Խ�ȶ������ȶ���������ΪH3P��
�ʴ�Ϊ��H3P��
��2������AΪ�������ڵĽ������ʣ�DΪ�����ڷǽ������ʣ�������Ԫ�ص�ԭ������A��D��2������Aԭ��������ż��������Ԫ�ص�ԭ������������D��A��2������A��Mg��D��CԪ�أ�F��Ũ��Һ��A��D��Ӧ���к���ɫ�������ɣ�����ɫ������NO2����F��HNO3��C��HNO3Ũ��Һ��Ӧ����CO2��NO2��H2O��B�ܺ�Mg��Ӧ����̼���ʣ���B��CO2��C��MgO��MgO�����ᷴӦ����Mg��NO3��2��H2O��Mg�����ᷴӦ����Mg��NO3��2����E��Mg��NO3��2��
ͨ�����Ϸ���֪��A��Mg��A��ԭ�ӽṹʾ��ͼΪ  ��
��
��Ӧ�ܵĻ�ѧ����ʽΪ�ڼ��������£�̼��Ũ���ᷢ��������ԭ��Ӧ���ɶ�����̼������������ˮ����Ӧ����ʽΪ��C+4HNO3��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CO2+4NO2��+2H2O��
�ʴ�Ϊ�� ��C+4HNO3��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CO2+4NO2��+2H2O��
��C+4HNO3��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CO2+4NO2��+2H2O��
��A��D��F���Ƕ����ڷǽ���Ԫ�ص��ʣ���A��D����Ԫ��ͬ���壬��BΪSiO2��A��F����Ԫ��ͬ���ڣ���AΪC��DΪSi��FΪO2������ת����ϵ��CΪCO��EΪCO2����Ӧ��ΪC���������ķ�Ӧ���÷�ӦΪ2C+SiO2$\frac{\underline{\;����\;}}{\;}$Si+2CO����
����״����3.36L������̼Ϊ��$\frac{3.36L}{22.4L/mol}$=0.15mol��10.0g ��������Ϊ��$\frac{10.0g}{40g/mol}$=0.25mol���������ʵ���֮��Ϊ3��5������2��1��1��1֮�䣬������Na2CO3��NaHCO3����������ʵ����ֱ�Ϊxmol��ymol����$\left\{\begin{array}{l}{x+y=0.15}\\{2x+y=0.25}\end{array}\right.$����ã�x=0.1��y=0.05��
�ʴ�Ϊ��2C+SiO2$\frac{\underline{\;����\;}}{\;}$Si+2CO����Na2CO2��0.1mol��NaHCO3��0.05mol��
���� ���⿼��������ƶϡ�ԭ�ӽṹ��Ԫ�������ɵĹ�ϵ�ȣ�Ϊ��Ƶ���㣬�漰����Ԫ�ؼ��仯����֪ʶ�Ŀ��飬����Ԫ�ص�λ�ü����ʵ������������ƶϸ����ʣ�ע��������ʵ�����Ԫ�ء����ʽṹ������֮���ת����ϵ�����ƶϣ���Ϥ�������ʼ��仯����������ǽⱾ��ؼ�����Ŀ�Ѷ��еȣ�

| ʵ��װ�� | ʵ������ |
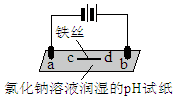 | a����ֽ������ b����죬�ֲ���ɫ�� c����ֽ������ d�������Ա仯 |
| A�� | aΪ���ص����� | |
| B�� | b�����������ɣ�����ˮ��Ӧ����������ʹ����� | |
| C�� | d�������˷�Ӧ��Fe-3e-=Fe3+ | |
| D�� | c����2H2O+2e-=H2��+2OH- |
| A�� | ��a=0.1ʱ�������ķ�ӦΪ2I-+Br2�TI2+2Br- | |
| B�� | ��a=0.25ʱ�������ķ�ӦΪ2Fe2++4I-+3Br2�T2Fe3++2I2+6Br- | |
| C�� | ����Һ��I-��һ�뱻�����ǣ�c��I-����c��Br-���T1��1 | |
| D�� | ��a=0.28ʱ��4Fe2++10I-+7Br2�T4Fe3++5I2+14Br- |
�ٽ�
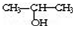 ��NaOH�Ĵ���Һ�����Ʊ�CH3-CH�TCH2
��NaOH�Ĵ���Һ�����Ʊ�CH3-CH�TCH2��
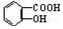 ������NaHCO3��Һ��Ӧ�Ʊ�
������NaHCO3��Һ��Ӧ�Ʊ�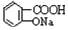
����Ũ��ˮ��ȥ���л��еı���
������ˮ���ɼ���CH2=CH-CHO�е�̼̼˫����
| A�� | ֻ�Тۢ� | B�� | ֻ�Т٢� | C�� | ֻ�Т� | D�� | ������ |
| A�� | ij�¶��£���ˮpH=6�����¶���1L pH=10�İ�ˮ�к���OH-��ĿΪ0.01NA | |
| B�� | 0.1mol•L-1��AlCl3��Һ��NaOH��Һ��Ӧ���ò����к�AlΪ0.1NA | |
| C�� | ������Zn��Ũ���Ṳ�ȿ����ɱ�״���µ�����2.24L����μӷ�Ӧ������Ϊ0.4NA | |
| D�� | 42gC3H6��C4H8�Ļ�������к��й��ۼ�����ĿΪ3NA |
��1��NԪ��λ�����ڱ���2����VA�壮
��2���á���������������=����գ�
| ���Ӱ뾶 | �õ������� | ���� | ������ |
| Cl-��Al3+ | 16O=18O | H2CO3��H2SiO3 | Cu��Al |
��4��д��MgCl2����ʽ��
 ��
����5����${\;}_{1}^{1}$H��${\;}_{1}^{2}$H��${\;}_{1}^{3}$H��${\;}_{12}^{23}$Mg��${\;}_{12}^{24}$Mg��${\;}_{29}^{65}$Cu�й���3��Ԫ�أ�6�ֺ��أ�
| ԭ����� | Z | N | A |
| 3919K | 19 | 20 | 39 |
| 168O | 8 | 8 | 16 |
| 4018Ar | 18 | 22 | 40 |
| A�� | ��Cl2��H2��Ϻ�ȼ�����Ȼ������壬�ٽ��Ȼ�������ͨ��ˮ�л������ | |
| B�� | �Ʊ����ᣬ��ˮ��������������������Ũ���� | |
| C�� | �����Ƽ����������̼ͨ�뺬�����Ȼ��Ʊ�����Һ�У����˵õ�̼�����ƾ��� | |
| D�� | �õ�������Ȼ����ͱ���ʯ�Ļ����ķ����õ��� |