题目内容
7.在有机物 中,在同一平面上碳原子最多有几个,在同一直线上的碳原子最多有几个( )
中,在同一平面上碳原子最多有几个,在同一直线上的碳原子最多有几个( )| A. | 11、4 | B. | 13、3 | C. | 13、4 | D. | 12、3 |
分析 苯环、碳碳双键为平面结构,碳碳三键为直线结构,而甲基、亚甲基均为四面体结构,以此来解答.
解答 解:苯环、碳碳双键为平面结构,碳碳三键为直线结构,且直线相连时一定共面,甲基、亚甲基中3个原子共面,则最多13个原子共面,而与碳碳三键相连的苯环中2个C与碳碳三键共线,即有4个碳原子共线,
故选C.
点评 本题考查有机物的结构,为高频考点,把握有机物的结构、共面与共线原子的判断为解答的关键,侧重分析与应用能力的考查,注意最多与至少碳原子的区别,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
4.热化学方程式中要注明物质状态的原因是( )
| A. | 便于判断性质 | B. | 物质呈现的状态跟它所含能量有关 | ||
| C. | 便于计算 | D. | 为了区别一般的化学方程式 |
5.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq) | |
| C. | 电池工作时,溶液中的OH-由负极向正极移动 | |
| D. | 外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g |
2.短周期元素W、X、Y、Z原子序数依次减小,它们原子的最外层电子数之和为14.X与Z同主族,Y与W同主族,且Y的原子半径大于Z.下列叙述正确的是( )
| A. | 原子半径:W>X>Y | |
| B. | X的单质不能与Z的氧化物反应 | |
| C. | W的单质在Y的单质中燃烧产生淡蓝色火焰 | |
| D. | X、Y可形成既有离子键又有共价键的离子化合物 |
2.Cu粉放入稀H2SO4中,加热后无现象,当加入一种盐后,Cu粉质量减少,而溶液变蓝,同时有气体生成,此盐是( )
| A. | 氯化物 | B. | 硫酸盐 | C. | 硝酸盐 | D. | 碳酸盐 |
12.下列关于药物的叙述正确的是( )
| A. | 在饭前服用鱼肝油,更有利于人体吸收药物的有效成分 | |
| B. | 可以用萃取等方法从中草药中提取有效成分 | |
| C. | 患有胃溃疡的患者可用小苏打治疗胃酸过多 | |
| D. | 服用铝膜包装的药品对人体没有任何危害 |
19.下列固体物质溶液水,再将其溶液加热,蒸发结晶、再灼烧,能得到化学组成与原固体物质相同的是( )
①胆矾 ②氯化铝 ③硫酸铝 ④纯碱 ⑤氯化铜.
①胆矾 ②氯化铝 ③硫酸铝 ④纯碱 ⑤氯化铜.
| A. | ③④ | B. | ①③④ | C. | ①②③④ | D. | 全部 |
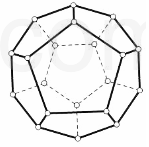 2000 年,德国Freiburg大学的H.Prinzbach宣称,他们通过摘除法,已经在气相质谱仪的气体中发现了最小的球碳分子(富勒烯)--C20(如图所示).然后在电子冲击质谱仪中观察到了微量C20+和C202+的存在. 他将C20H20 溶解在液溴里,在烧瓶里加压长时间回流,最终得到平均组成为 C20HBr13的产物.
2000 年,德国Freiburg大学的H.Prinzbach宣称,他们通过摘除法,已经在气相质谱仪的气体中发现了最小的球碳分子(富勒烯)--C20(如图所示).然后在电子冲击质谱仪中观察到了微量C20+和C202+的存在. 他将C20H20 溶解在液溴里,在烧瓶里加压长时间回流,最终得到平均组成为 C20HBr13的产物.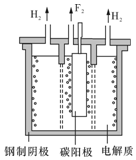 氟是自然界中广泛分布的元素之一.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异.
氟是自然界中广泛分布的元素之一.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异.