题目内容
19.合成氨工业对国民经济和社会发展具有重要的意义.哈伯法合成氨需要在20-50MPa的高压和500℃的高温下,并用铁作为催化剂,氨的转化率为10%-15%.最近美国俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)2的催化剂,在常温下合成出氨,反应方程式可表示为N2+3H2→2NH3,有关说法正确的是( )| A. | 哈伯法合成氨是吸热反应,新法合成氨是放热反应 | |
| B. | 新法合成和哈伯法相比不需要在高温条件下,可节约大量能源,具有发展前景 | |
| C. | 新法合成能在常温下进行是因为不需要断裂化学键 | |
| D. | 新的催化剂升高了反应所需要的能量,提高了活化分子百分数 |
分析 A.合成氨都是放热反应,催化剂不会改变反应热;
B.根据题目给出信息“在常温下合成氨”来分析解答;
C.化学反应都涉及旧键的断裂和新键的生成;
D.加入催化剂,能降低反应所需要能量,增大活化分子数目,进而增大反应速率.
解答 解:A.哈伯法合成氨和新法合成氨都是放热反应,使用催化剂不会改变反应热,故A错误;
B.题目给出信息“在常温下合成氨”,所以不需要在高温条件下,可节约大量能源,具有发展前景,故B正确;
C.化学反应的本质为原子的重新组合,所以任何化学反应都涉及旧键的断裂和新键的生成,故C错误;
D.催化剂能降低反应的活化能,提高活化分子百分数,不是新的催化剂升高了反应所需要的能量,故D错误.
故选B.
点评 本题主要考查催化剂对化学反应的影响因素以及与反应热间的关系等知识,注意题干信息的应用,主要催化剂能降低反应所需要能量,增大活化分子数目,为高频考点,题目难度不大.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
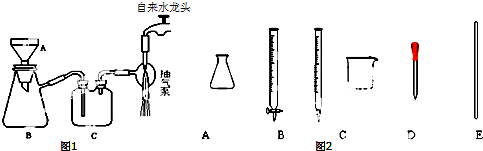
19.下列图示实验正确的是( )
| A. | 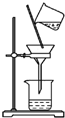 除去粗盐溶液中的不溶物(滤纸未画出) | |
| B. | 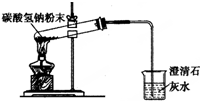 碳酸氢钠受热分解 | |
| C. | 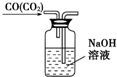 除去CO中的CO2 | |
| D. | 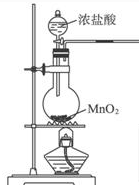 制取氯气 |
10.在一定温度下,对于可逆反应A(g)+2B(g)?3C(g),已达到平衡的标志是( )
| A. | C生成的速率与C分解的速率相等 | |
| B. | 单位时间内生成a mol A,同时生成2a mol B | |
| C. | 容器内各组分的总质量不再变化 | |
| D. | 混合气体的总物质的量不再变化 |
7.若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化.在变化的各阶段被破坏的粒子间的主要相互作用依次是( )
| A. | 氢键 分子间作用力 非极性键 | B. | 氢键 氢键 极性键 | ||
| C. | 氢键 极性键 分子间作用力 | D. | 分子间作用力 氢键 非极性键 |
8.某环境网站的一幅图如下,有关说法正确的( )
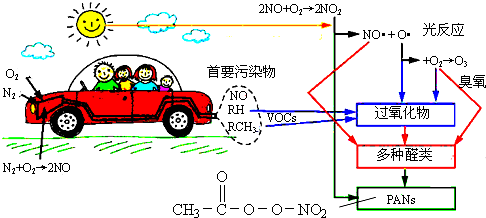

| A. | 汽车尾气中的NO、碳氢化合物(图中RH和RCH3)均来自燃油 | |
| B. | 醛类、PANs(过氧乙酰硝酸酯)均属于无机物 | |
| C. | O3污染、硝酸型酸雨及雾霾均与汽车尾气排放无关 | |
| D. | 汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因之一是N2与O2的反应速率加快 |

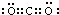 、
、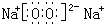 ;
;
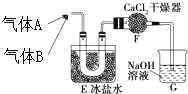 三种常见短周期元素组成的化合物甲,是有机合成中的重要试剂.常温下为黄色气体,具有刺鼻恶臭味,遇水和潮气分解.标况下测定其密度为2.92g/L.浓硝酸与浓盐酸混合制王水过程中会产生少量甲气体、黄绿色气体A和水.
三种常见短周期元素组成的化合物甲,是有机合成中的重要试剂.常温下为黄色气体,具有刺鼻恶臭味,遇水和潮气分解.标况下测定其密度为2.92g/L.浓硝酸与浓盐酸混合制王水过程中会产生少量甲气体、黄绿色气体A和水.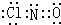 .
.