题目内容
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是(其他操作均正确)( )
| A、溶解后未冷却至室温就移入容量瓶 |
| B、向容量瓶加水时液面低于刻度线即摇匀 |
| C、称量时间过长 |
| D、向容量瓶加水定容时眼睛俯视刻度线 |
考点:溶液的配制
专题:化学实验基本操作
分析:根据c=
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
| n |
| V |
解答:
解:A、溶解后未冷却至室温就移入容量瓶,则冷却后溶液体积会偏小,则浓度偏高,故A不选;
B、向容量瓶加水时液面低于刻度线即摇匀,即溶液体积偏小,则浓度偏高,故B不选;
C、氢氧化钠固体易潮解,如果称量时间过长,则称量出的真正的氢氧化钠的质量偏小,则浓度偏低,故C选;
D、向容量瓶加水定容时眼睛俯视刻度线,会造成溶液体积偏小,则浓度偏高,故D不选.
故选C.
B、向容量瓶加水时液面低于刻度线即摇匀,即溶液体积偏小,则浓度偏高,故B不选;
C、氢氧化钠固体易潮解,如果称量时间过长,则称量出的真正的氢氧化钠的质量偏小,则浓度偏低,故C选;
D、向容量瓶加水定容时眼睛俯视刻度线,会造成溶液体积偏小,则浓度偏高,故D不选.
故选C.
点评:本题考查了一定物质的量浓度溶液的配制过程中的误差分析,学会分析错误操作对溶质的质量和溶液体积造成的影响是解题关键,属于基础型题目,难度不大.

练习册系列答案
相关题目
用已被部分氧化的金属屑A制备某工业常用盐C的步骤如下:将C溶于水,向其中滴入NaOH溶液,出现白色沉淀,后逐渐变为红褐色,下列判断正确的是( )
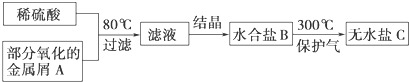

| A、过滤所得的残渣中一定没有金属A |
| B、滤液可能是CuSO4溶液或MgSO4溶液 |
| C、水合盐B可能是FeSO4?7H2O |
| D、无水盐C可能是Fe2(SO4)3 |
对蛋白质与氨基酸的下列看法,正确的是( )
| A、蛋白质都难溶于水,所以需在蛋白酶的作用下水解,方可被人体吸收 |
| B、有些易溶于水的蛋白质,被人体摄入后,不需水解成氨基酸,就可被人体吸收 |
| C、在浓硫酸钠溶液中,鸡蛋白能析出,在浓盐酸中,猪肝蛋白会发生变性 |
| D、天然蛋白质水解产物都是α氨基酸,都只含1个羧基和1个氨基 |
如图是制取气体的一种装置,能用此装置制取气体并能“随开随用,随关随停”的是( )


| A、二氧化锰与浓盐酸制Cl2 |
| B、过氧化钠与水制O2 |
| C、锌与稀硫酸制H2 |
| D、电石与水制取C2H2 |
室温下,甲、乙两烧杯均盛有5mLpH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4.关于甲、乙两烧杯中溶液的描述正确的是( )
| A、水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙 |
| B、溶液的体积:10V甲≤V乙 |
| C、若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 |
| D、若分别与5mLpH=11的NaOH溶液反应,所得溶液的pH:甲≥乙 |

 的名称:
的名称: