题目内容
某同学配制一定物质的量浓度的硫酸溶液,下列情况会造成所配溶液浓度偏低的是( )
| A、定容时时俯视刻度线 |
| B、量筒量取5ml浓硫酸时俯视读数 |
| C、容量瓶中有蒸馏水 |
| D、溶解后未经冷却就转移到容量瓶进行定容 |
考点:配制一定物质的量浓度的溶液
专题:
分析:根据c=
分析判断误差,如果n偏小或V偏大则配制溶液浓度偏低.
| n |
| V |
解答:
解:A.定容时俯视刻度,液面低于刻度线,溶液的体积偏小,浓度偏大,故A错误;
B.用量筒量取浓硫酸时,俯视读数会导致溶液体积偏小,所配溶液浓度偏低,故B正确;
C.容量瓶中原有少量蒸馏水,溶质的物质的量和溶液的体积不变,配制溶液浓度不变,故C错误;
D.未冷却即转移、定容,导致溶液体积偏小,则配制溶液浓度偏高,故D错误;
故选B.
B.用量筒量取浓硫酸时,俯视读数会导致溶液体积偏小,所配溶液浓度偏低,故B正确;
C.容量瓶中原有少量蒸馏水,溶质的物质的量和溶液的体积不变,配制溶液浓度不变,故C错误;
D.未冷却即转移、定容,导致溶液体积偏小,则配制溶液浓度偏高,故D错误;
故选B.
点评:本题考查一定物质的量浓度的溶液的配制误差分析,根据c=
分析判断误差,题目难度不大,注意易错点为A、B,注意仰视、俯视对体积读数的影响.
| n |
| V |

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
下图为向25ml0.1mol/LNaOH溶液中逐滴0.2mol/L醋酸溶液,曲线如下图所示,在AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )
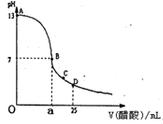

| A、c(OH-)一定大于c(CH3COO-) |
| B、c(OH-)一定小于c(CH3COO-) |
| C、c(OH-)一定等于c(CH3COO-) |
| D、上述三种情况都可能 |
下列做法不利于食品安全的是( )
| A、在食盐中添加适量的碘酸钾 |
| B、用甲醛浸泡食品,使其不易变质 |
| C、在食品加工中科学地使用食品添加剂 |
| D、研发高效低毒的农药,降低蔬菜的农药残留量 |
 某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.
某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.