题目内容
5.氨水中的粒子数为( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
分析 氨水是氨气的水溶液,存在平衡NH3+H2O?NH3•H2O?NH4++OH-,据此回答.
解答 解:氨水是氨气的水溶液,存在平衡NH3+H2O?NH3•H2O?NH4++OH-,存在的离子有:铵根离子、氢氧根离子、氢离子、一水合氨分子、水分子,氨气分子,共六种粒子.
故选D.
点评 本题考查学生氨水的成分以及弱电解质的电离知识,属于综合知识的考查,难度中等.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
15.下列关于胶体的叙述正确的是( )
| A. | 胶体不稳定,静置后容易产生沉淀 | |
| B. | 可用丁达尔效应区别溶液与悬浊液 | |
| C. | 溶液中溶质粒子不能通过半透膜,胶体中分散质粒子能透过半透膜 | |
| D. | 胶体与其他分散系的本质区别是分散质粒子直径在1 nm~100nm之间 |
16.己知丙烷的燃烧热△H=-2200KJ•mol-1,若一定量的丙烷(C3H8)完全燃烧后生成18g水,则放出的热量约为( )
| A. | 55 kJ | B. | 220 kJ | C. | 1108 kJ | D. | 550 kJ |
13.下列说法正确的是( )
| A. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| B. | 分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种 | |
| C. | 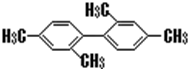 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 | |
| D. | 1mol有机物 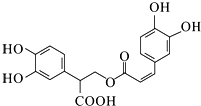 一定条件下能和7molNaOH反应 一定条件下能和7molNaOH反应 |
20.已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2.下列有关离子反应或离子方程式的叙述中,正确的是( )
| A. | 向0.1molFeI2溶液中滴加少量氯水,反应中有0.3mol电子转移 | |
| B. | 向溴水中加入足量氯化亚铁能使溶液变成无色 | |
| C. | 向NaClO溶液中通入少量CO2的离子方程式:ClO-+CO2+H2O═HClO+HCO3- | |
| D. | 能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存 |
10.图中,表示正反应是吸热反应的是( )
| A. |  | B. |  | C. |  | D. |  |
17.下列物质发生反应时其离子方程式正确的是( )
| A. | 铁与三氯化铁溶液反应:Fe+2Fe3+=3Fe2+ | |
| B. | 氯化铝溶液中加入过量的氨水Al3++4NH3•H2O=4NH4++AlO2-+2H2O | |
| C. | Fe(OH)3跟盐酸反应:Fe(OH)3+3H+=Fe3++3H2O | |
| D. | 钠和冷水反应:Na+2H2O=Na++H2↑+2OH- |
5.下列反应的离子方程式正确的是( )
| A. | 向银氨溶液中加入足量氢溴酸溶液:Ag(NH3)2++OHˉ+3H+═Ag++2NH4++H2O | |
| B. | 向0.1 mol/L pH=1的NaHA的溶液中加入NaOH溶液:HA-+OH-═H2O+A2- | |
| C. | H2C2O4使酸性KMnO4溶液褪色:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:2Ba2++2SO42-+4OH-+Al3+═2BaSO4↓+AlO2-+2H2O |

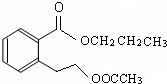 或
或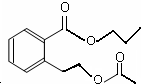 .
.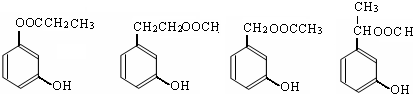 (其中一种).
(其中一种).