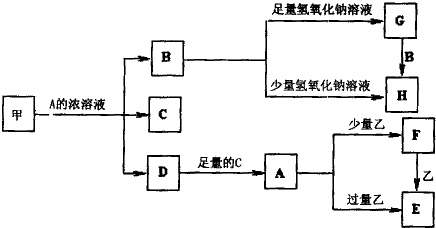
题目内容
某探究性学习小组拟通过锌与盐酸的反应研究影响反应速率的因素.
(1)测定该反应速率的方法有多种,不同的方法需要测定不同的数据.该探究性学习小组设计如下测定方法,需要记录的数据如下:
① ;
②生成氢气的体积.
根据测定的实验数据,处理后可求得氢气的反应速率.
(2)该探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
①该实验的目的是探究 、 对锌和稀盐酸反应速率的影响;
②实验Ⅰ和Ⅱ表明 ,化学反应速率越大;
③实验Ⅱ和Ⅲ表明 ,化学反应速率越大.
(1)测定该反应速率的方法有多种,不同的方法需要测定不同的数据.该探究性学习小组设计如下测定方法,需要记录的数据如下:
①
②生成氢气的体积.
根据测定的实验数据,处理后可求得氢气的反应速率.
(2)该探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| Ⅰ | 薄片 | 15 | 200 |
| Ⅱ | 薄片 | 25 | 90 |
| Ⅲ | 粉末 | 25 | 10 |
②实验Ⅰ和Ⅱ表明
③实验Ⅱ和Ⅲ表明
考点:探究影响化学反应速率的因素
专题:化学反应速率专题
分析:(1)①反应速率是通过测定收集等体积H2需要的时间来测定的;
(2)①由表格中的数据可知,锌的状态不同、温度不同;
②实验Ⅰ和Ⅱ中,温度对反应速率有影响,温度越高,化学反应速率越大;
③实验Ⅱ和Ⅲ中,固体的表面积对反应速率有影响,表面积越大,化学反应速率越大.
(2)①由表格中的数据可知,锌的状态不同、温度不同;
②实验Ⅰ和Ⅱ中,温度对反应速率有影响,温度越高,化学反应速率越大;
③实验Ⅱ和Ⅲ中,固体的表面积对反应速率有影响,表面积越大,化学反应速率越大.
解答:
解:(1)①反应速率是通过测定收集等体积H2需要的时间来测定的;故答案为:反应时间;
(2)①由表格中的数据可知,锌的状态不同、温度不同,则实验目的为探究接触面积、温度对锌和稀盐酸反应速率的影响,故答案为:接触面积;温度;
②实验Ⅰ和Ⅱ中,温度不同,温度大的反应速率快,即温度越高,反应速率越快,故答案为:温度越高;
③实验Ⅱ和Ⅲ中,固体表面积不同,表面积大的反应速率快,即固体表面积越大,反应速率越快,故答案为:固体表面积越大.
(2)①由表格中的数据可知,锌的状态不同、温度不同,则实验目的为探究接触面积、温度对锌和稀盐酸反应速率的影响,故答案为:接触面积;温度;
②实验Ⅰ和Ⅱ中,温度不同,温度大的反应速率快,即温度越高,反应速率越快,故答案为:温度越高;
③实验Ⅱ和Ⅲ中,固体表面积不同,表面积大的反应速率快,即固体表面积越大,反应速率越快,故答案为:固体表面积越大.
点评:本题考查影响化学反应速率的实验探究,为高频考点,把握常见的外因及实验中控制变量法的应用为解答的关键,题目难度不大.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
下列说法正确的是( )
| A、气体摩尔体积就是22.4L/mol |
| B、非标准状况下,1mol任何气体的体积不可能为22.4L |
| C、标准状况下22.4L任何物质都含有约6.02×1023个分子 |
| D、1molH2和O2的混合气体在标准状况下的体积约22.4L |
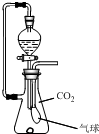 在抽滤瓶内放一小块金属钠,同时收集满CO2气体并塞紧瓶塞.从分液漏斗中放入一定量的水,待钠完全反应并恢复到反应前温度时,发现气球凹瘪,则抽滤瓶内溶液中的溶质是( )
在抽滤瓶内放一小块金属钠,同时收集满CO2气体并塞紧瓶塞.从分液漏斗中放入一定量的水,待钠完全反应并恢复到反应前温度时,发现气球凹瘪,则抽滤瓶内溶液中的溶质是( )| A、NaOH与Na2CO3 |
| B、Na2CO3 |
| C、Na2CO3与NaHCO3 |
| D、NaHCO3 |
下列实验方案设计合理且能达到相应实验预期目的是( )
A、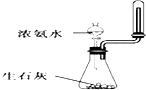 制取少量氨气 |
B、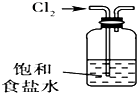 除去氯气中的HCl杂质 |
C、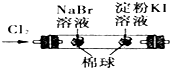 证明氧化性Cl2>Br2>I2 |
D、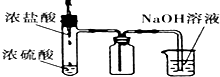 制取HCl且除去多余的气体 |
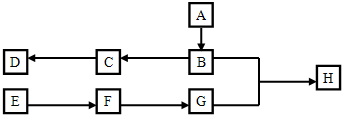
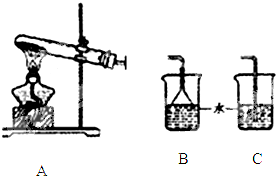 某研究性学习小组为了制取并探究氨气的性质,进行以下实验.[装置A中发生反应的化学方程式:2NH4Cl+Ca(OH)2
某研究性学习小组为了制取并探究氨气的性质,进行以下实验.[装置A中发生反应的化学方程式:2NH4Cl+Ca(OH)2