题目内容
1.分子式为C4H8ClBr且分子结构中含有2个甲基的有机物共有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
分析 C4H8ClBr可以看作C4H10中2个H原子被Cl、Br原子取代,而丁烷有CH3CH2CH2CH3、CH3CH(CH3)2两种,结合取代产物含有2个甲基书写判断.
解答 解:C4H8ClBr可以看作C4H10中2个H原子被Cl、Br原子取代,而丁烷有CH3CH2CH2CH3、CH3CH(CH3)2两种,
CH3CH2CH2CH3中H原子被取代,有:CH3CBrClCH2CH3;CH3CHBrCHClCH3;
CH3CH(CH3)2中H原子被取代,有:CHBrClCH(CH3)2、CH2BrCCl(CH3)2、CH2ClCBr(CH3)2
含有两个甲基的有机物有5种,
故选:C.
点评 本题考查限制条件同分异构体的书写,难度中等,注意利用取代法进行判断.

练习册系列答案
相关题目
12.根据相应的图象(图象编号与答案一一对应),判断下列相关说法正确的是( )
| A. | 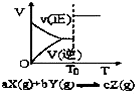 密闭容器中反应达到平衡,T0时改变某一条件有如图变化所示,则改变的条件一定是加入催化剂 | |
| B. | 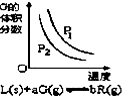 反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b | |
| C. | 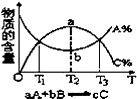 物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应 | |
| D. | 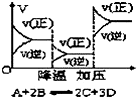 反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A、B、C是气体、D为固体或液体 |
9.通过化学实验现象得出相应的结论是探究物质性质的一种重要方法,下列化学实验现象与结论对应完全正确的是( )
| 化学实验现象 | 解释与结论 | |
| A | 钠与水反应时浮在水面上 | 钠与水生成的气体托举钠浮在水面上 |
| B | 铁与氯气反应剧烈燃烧产生红棕色的烟 | 产物为红棕色小颗粒,燃烧不一定需要氧气 |
| C | 氯水呈黄绿色 | 氯气与水反应生成了黄绿色物质 |
| D | 氢气在氯气中燃烧时瓶口有白雾 | 氯气逸出结合空气中的水蒸气而呈白雾状 |
| A. | A | B. | B | C. | C | D. | D |
16.在“绿色化学”工艺中,理想的状态是反应物中的原子全部转化为期望的最终产物,不产生副产物,实现零排放.即原子的利用率为100%.下列反应类型中能体现“原子经济性”原则的是( )
①置换反应 ②化合反应 ③分解反应 ④取代反应 ⑤加成反应 ⑥加聚反应.
①置换反应 ②化合反应 ③分解反应 ④取代反应 ⑤加成反应 ⑥加聚反应.
| A. | ①②⑤ | B. | ②⑤⑥ | C. | ③④ | D. | 只有⑥ |
6.下列叙述正确的是( )
| A. | Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 | |
| B. | Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀 | |
| C. | 某物质灼烧时,焰色反应呈现黄色,一定不含钾元素 | |
| D. | Na2O2可作供氧剂,而Na2O不行 |
11.硫代硫酸钠俗称保险粉,又名“大苏打”.可用于照相业作定影剂、纸浆漂白作脱氯剂,也可用于氰化物、砷、汞、铅、铋、碘等中毒的治疗,也是一种常用的实验试剂.
Ⅰ.已知:Na2S2O3+H2SO4═Na2SO4+S↓+SO2+H2O,某研究小组依据该反应探究外界条件对反应速率的影响,设计实验如下:
下列有关说法正确的是AD
A.实验①和②探究其他条件不变时Na2S2O3浓度对相关反应速率的影响
B.实验①和③溶液变浑浊的时间相同
C.其他条件不变时,探究温度对化学反应速率的影响,应选择实验③和⑤
D.该同学在实验中采用的研究方法是实验比较法
Ⅱ.实验室用SO2通入Na2S和Na2CO3的混合溶液中来制备硫代硫酸钠.反应原理为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2本实验对Na2S纯度要求较高,利用图1所示的装置可将工业级的Na2S提纯.已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精.提纯过程为:将已称量好的工业级Na2S放入圆底烧瓶中,加入一定质量的酒精和少量水.按图1所示装配所需仪器,向冷凝管通入冷却水,同时水浴加热.待烧瓶中固体不再减少时,停止加热.将烧瓶取下,立即趁热过滤,再冷却结晶,过滤.将所得固体洗涤、干燥,得到Na2S•9H2O晶体.

(1)在提纯过程中“趁热过滤”操作的目的是防止硫化钠结晶析出而损失、去除杂质;
(2)用图2所示装置制取Na2S2O3,其中盛放Na2SO3固体的玻璃仪器名称是蒸馏烧瓶,NaOH溶液的作用是吸收SO2等尾气,防止污染.
(3)保险粉样品中Na2S2O3•5H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为2Na2S2O3+I2═2NaI+Na2S4O6.
准确称取W g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂.用0.1000 mol•L?1碘的标准溶液进行滴定.
请回答:
①到达滴定终点的标志滴入最后一滴碘的标准溶液,溶液变为蓝色,且30s内不恢复原色;
②滴定起始和终点的液面位置如图3,则消耗碘的标准溶液体积为18.10mL,产品的纯度为$\frac{0.362M}{W}$%(设Na2S2O3•5H2O相对分子质量为M).
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的纯度的测量结果偏低(填“偏高”、“偏低”或“不变”).
Ⅰ.已知:Na2S2O3+H2SO4═Na2SO4+S↓+SO2+H2O,某研究小组依据该反应探究外界条件对反应速率的影响,设计实验如下:
| 实验 编号 | 实验温度 /℃ | Na2S2O3 | H2SO4 | 蒸馏水体积 /mL | ||
| 体积/mL | 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | |||
| ① | 25 | 10 | 0.1 | 10 | 0.1 | 0 |
| ② | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| ③ | 25 | 5 | 0.2 | 10 | 0.2 | 5 |
| ④ | 50 | 5 | 0.1 | 10 | 0.1 | 5 |
| ⑤ | 50 | 10 | 0.2 | 5 | 0.2 | 5 |
A.实验①和②探究其他条件不变时Na2S2O3浓度对相关反应速率的影响
B.实验①和③溶液变浑浊的时间相同
C.其他条件不变时,探究温度对化学反应速率的影响,应选择实验③和⑤
D.该同学在实验中采用的研究方法是实验比较法
Ⅱ.实验室用SO2通入Na2S和Na2CO3的混合溶液中来制备硫代硫酸钠.反应原理为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2本实验对Na2S纯度要求较高,利用图1所示的装置可将工业级的Na2S提纯.已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精.提纯过程为:将已称量好的工业级Na2S放入圆底烧瓶中,加入一定质量的酒精和少量水.按图1所示装配所需仪器,向冷凝管通入冷却水,同时水浴加热.待烧瓶中固体不再减少时,停止加热.将烧瓶取下,立即趁热过滤,再冷却结晶,过滤.将所得固体洗涤、干燥,得到Na2S•9H2O晶体.

(1)在提纯过程中“趁热过滤”操作的目的是防止硫化钠结晶析出而损失、去除杂质;
(2)用图2所示装置制取Na2S2O3,其中盛放Na2SO3固体的玻璃仪器名称是蒸馏烧瓶,NaOH溶液的作用是吸收SO2等尾气,防止污染.
(3)保险粉样品中Na2S2O3•5H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为2Na2S2O3+I2═2NaI+Na2S4O6.
准确称取W g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂.用0.1000 mol•L?1碘的标准溶液进行滴定.
请回答:
①到达滴定终点的标志滴入最后一滴碘的标准溶液,溶液变为蓝色,且30s内不恢复原色;
②滴定起始和终点的液面位置如图3,则消耗碘的标准溶液体积为18.10mL,产品的纯度为$\frac{0.362M}{W}$%(设Na2S2O3•5H2O相对分子质量为M).
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的纯度的测量结果偏低(填“偏高”、“偏低”或“不变”).
 ;
;