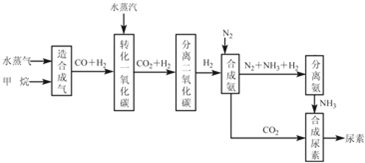
题目内容
下列电离方程式书写正确的是( )
| A、H2S?2H++S2- | ||
| B、H2S+H2O?H3O++HS- | ||
C、NH3+H2O═NH
| ||
| D、HClO═H++ClO |
考点:电离方程式的书写
专题:电离平衡与溶液的pH专题
分析:强电解质完全电离,溶质微粒在溶液中以离子形式存在,书写电离方程式用等号;弱电解质只有少部分电离,溶质微粒在溶液中多数以分子形式存在,少数以离子形式存在,书写电离方程式用可逆号,多元弱酸分步电离,多元弱碱一步写到位.
解答:
解:A.H2S为多元弱酸应该分步电离,H2S?H++HS-、HS-H++S2-,故A错误;
B.H2S为多元弱酸应该分步电离,以第一步电离为主,电离方程式为:H2S+H2O?H3O++HS-,故B正确;
C.一水合氨是弱电解质用可逆号,则NH3+H2O?NH4++OH-,故C错误;
D.HClO是弱电解质用可逆号,则HClO?H++ClO-,故D错误;
故选B.
B.H2S为多元弱酸应该分步电离,以第一步电离为主,电离方程式为:H2S+H2O?H3O++HS-,故B正确;
C.一水合氨是弱电解质用可逆号,则NH3+H2O?NH4++OH-,故C错误;
D.HClO是弱电解质用可逆号,则HClO?H++ClO-,故D错误;
故选B.
点评:本题考查电解质电离方程式的书写,题目难度较小.易错点:1、多元弱酸分步电离,以第一步为主;2、多元弱酸的酸式根离子不能拆;3、多元弱碱虽然一步写到位但因为是弱电解质所以仍然用可逆号.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案
相关题目
在20℃、1.01×105的条件下,20mL某气态烃与过量的O2混合,完全燃烧后的产物通过浓H2SO4,再恢复到室温,气体体积减少了50mL.剩余气体再通过苛性钠溶液,体积又减少了40mL,则气态烃的分子式为( )
| A、CH4 |
| B、C2H5 |
| C、C2H6 |
| D、C4H10 |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,11.2L NH3所含的原子数为2NA |
| B、常温常压下,80g SO3含有的氧原子数为3NA |
| C、标准状况下,22.4L H2中所含原子数为NA |
| D、标准状况下,22.4L水中所含的分子数约为6.02×1023 |
a毫升A、B、C三种气态烃的混合物跟足量氧气混合点燃后,恢复到原常温常压状态,气体体积共缩小了2a毫升,那么A、B、C三种烃可能是( )
| A、CH4、C2H6、C3H8 |
| B、C2H4、C2H6、CH4 |
| C、CH4、C2H2、C2H6 |
| D、C2H6、C3H6、C4H6 |
99毫升0.1mol/L盐酸和101毫升0.05mol/L氢氧化钡溶液相混和后,溶液的pH值为( )
| A、1.7 | B、10.7 |
| C、11 | D、11.3 |
在25℃时,将两个铜电极插入到一定的Na2SO4饱和溶液中,通直流电电解并不断搅拌,当阴极上收集到a mol的气体的同时,溶液中析出了b mol的结晶水合物Na2SO4?10H2O,若保持温度不变,则所剩溶液中溶质的质量分数是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
通常情况,下列气体能大量共存的是( )
| A、NO、O2 |
| B、SO2、H2S |
| C、NH3、HCl |
| D、H2、O2 |