题目内容
由表中左边的实验现象可得出右边的实验结论的是( )
| 实验 | 现象 | 结论 |
| A | 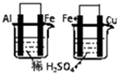 左边烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | 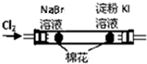 左边棉花变橙色,右边棉花变蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 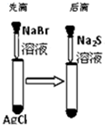 白色固体先变为浅黄色,后变为黑色 | 溶解性:AgCl<AgBr<Ag2S |
| D | 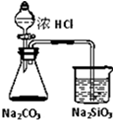 锥形瓶中有气体产生,烧杯中溶液变浑浊 | 酸性:盐酸>碳酸>硅酸 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.形成原电池反应,活泼金属为负极;
B.与碘化钾反应的物质的可能为氯气或溴,不能排除氯气的影响;
C.从难溶电解质的溶解平衡的角度思考;
D.盐酸易挥发,不能排除盐酸的干扰.
B.与碘化钾反应的物质的可能为氯气或溴,不能排除氯气的影响;
C.从难溶电解质的溶解平衡的角度思考;
D.盐酸易挥发,不能排除盐酸的干扰.
解答:
解:A.形成原电池反应,活泼金属为负极,正极发生还原反应生成气体,则可说明活动性:Al>Fe>Cu,故A正确;
B.与碘化钾反应的物质的可能为氯气或溴,不能排除氯气的影响,故B错误;
C.白色固体先变为浅黄色,后变为黑色,说明溶解性AgCl>AgBr>Ag2S,故错误;
D.盐酸易挥发,不能排除盐酸的干扰,生成二氧化碳后应用饱和碳酸氢钠溶液除杂,故D错误.
故选A.
B.与碘化钾反应的物质的可能为氯气或溴,不能排除氯气的影响,故B错误;
C.白色固体先变为浅黄色,后变为黑色,说明溶解性AgCl>AgBr>Ag2S,故错误;
D.盐酸易挥发,不能排除盐酸的干扰,生成二氧化碳后应用饱和碳酸氢钠溶液除杂,故D错误.
故选A.
点评:本题考查化学实验方案的评价,为高频考点,把握物质的性质、原电池知识、难溶电解质的溶解平衡、实验基本操作等为解答的关键,侧重物质性质及实验能力的综合考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
甲基环己烷( )的一氯代物有( )
)的一氯代物有( )
 )的一氯代物有( )
)的一氯代物有( )| A、3种 | B、4种 | C、5种 | D、6种 |
下列实验操作或装置不能达到目的是( )
A、 稀释浓硫酸 |
B、 分液 |
C、 定容 |
D、 过滤 |
分子式为C5H12和C5H11Cl的化合物,各有几种不同的结构( )
| A、2种 3种 |
| B、3种 8种 |
| C、4种 10中 |
| D、5种 12种 |
下列反应的离子方程式正确的是( )
| A、Fe3O4与稀硝酸反应:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| B、用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O |
| C、Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
| D、氨水与醋酸反应:NH3?H2O+CH3COOH?CH3COO-+NH4++H2O |
下列关于反应能量的说法正确的是( )
| A、Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s);△H=-216 kJ?mol-1,E反应物<E生成物 | ||||
| B、CaCO3(s)=CaO(s)+CO2(g);△H=+178.5 kJ?mol-1,E反应物<E生成物 | ||||
C、HI(g)=
| ||||
| D、H+(aq)+OH-(aq)=H2O(l)△H=-57.2 kJ?mol-1,含1 mol NaOH水溶液与含0.5 mol的浓硫酸混合后放热57.2 kJ |
下列电离方程式书写正确的是( )
| A、H2S?2H++S2- | ||
| B、H2S+H2O?H3O++HS- | ||
C、NH3+H2O═NH
| ||
| D、HClO═H++ClO |
下列反应属于取代反应的是( )
| A、C2H4通入溴水中,溴水褪色 |
| B、C2H4通入KMnO4酸性溶液中,溶液褪色 |
| C、苯与溴水混合后振荡,水层褪色 |
| D、CH4与Cl2的混合气体光照后颜色变浅 |