题目内容
3.随着卤族元素核电核数的增大,下列递变规律正确的是( )| A. | 单质的颜色逐渐加深 | B. | 单质的熔沸点逐渐降低 | ||
| C. | 单质的密度逐渐减小 | D. | 单质在水中的溶解度逐渐增大 |
分析 A.卤素单质的颜色随着原子序数增大而加深;
B.分子晶体熔沸点与其相对分子质量成正比;
C.卤素单质的密度随着原子序数增大而增大;
D.卤素单质在水中的溶解度随着原子序数增大而减小.
解答 解:A.氟气淡黄绿色气体、氯气是黄绿色气体、溴是深红棕色液体、碘是紫黑色固体,所以卤素单质的颜色随着原子序数增大而加深,故A正确;
B.分子晶体熔沸点与其相对分子质量成正比,卤素单质都是分子晶体,其单质的相对分子质量随着原子序数增大而增大,所以其单质的熔沸点随着原子序数增大而增大,故B错误;
C.卤素单质的密度随着原子序数增大而增大,故C错误;
D.氟气极易和水反应生成氢氟酸,氯气和水反应生成盐酸和次氯酸,溴在水中的溶解度较小,碘在水中的溶解度更小,所以卤素单质在水中的溶解度随着原子序数增大而减小,故D错误;
故选A.
点评 本题考查卤族元素性质递变规律,为高频考点,明确同一主族元素原子结构与其元素性质关系是解本题关键,熟练掌握元素周期律,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
13.下列反应的离子方程式书写正确的是( )
| A. | AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O | |
| B. | 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+═I2+O2↑+2H2O | |
| C. | 在氢氧化钡溶液中滴加硫酸氢钾溶液至PH=7:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 用碳酸钠溶液浸泡锅炉水垢:Ca2++CO32-═CaCO3↓ |
14.汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,汽车尾气的治理已经迫在眉睫.
(1)尾气中的CO主要来自于汽油的不完全燃烧.
①有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g)△H=+221kJ•mol-1,简述该设想能否实现否(填“是”或“否”)依据是:该反应是焓增、熵减的反应,任何温度下均不能自发进行.
②研究表明:反应CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
该反应的△H<0(填“>”或“<”)若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020mol•L-1,在该条件下达到平衡时,CO的转化率为75%.
(2)用CO做燃料电池电解NaCl溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极,转移0.4mol e-后,断开K.
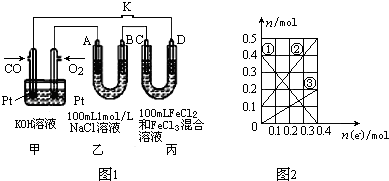
①乙中产生的气体在标准状况下的体积为7.28L.
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要280mL 5.0mol•L-1 NaOH溶液.
(3)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如图2所示,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,电解池阴极反应为2NOx+4xe-=N2+2xO2-.
(4)尾气中的碳氢化合物,如甲烷,可以用来制备氢气.其反应方程式为:
CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ/mol
[其中投料比n(CH4):n(H2O)=1:1].
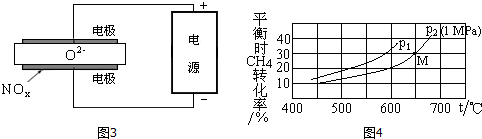
对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP,分压=总压×物质的量分数).平衡时CH4的转化率与温度、压强(总压)的关系如图4所示:
则p1< p2 (填“>”或“<”),p2时M点的平衡常数KP=0.066(小数点后保留3位).
(1)尾气中的CO主要来自于汽油的不完全燃烧.
①有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g)△H=+221kJ•mol-1,简述该设想能否实现否(填“是”或“否”)依据是:该反应是焓增、熵减的反应,任何温度下均不能自发进行.
②研究表明:反应CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(2)用CO做燃料电池电解NaCl溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极,转移0.4mol e-后,断开K.

①乙中产生的气体在标准状况下的体积为7.28L.
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要280mL 5.0mol•L-1 NaOH溶液.
(3)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如图2所示,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,电解池阴极反应为2NOx+4xe-=N2+2xO2-.

(4)尾气中的碳氢化合物,如甲烷,可以用来制备氢气.其反应方程式为:
CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ/mol
[其中投料比n(CH4):n(H2O)=1:1].
对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP,分压=总压×物质的量分数).平衡时CH4的转化率与温度、压强(总压)的关系如图4所示:
则p1< p2 (填“>”或“<”),p2时M点的平衡常数KP=0.066(小数点后保留3位).
11.以下反应属于加成反应的是( )
| A. | 乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯使溴的四氯化碳溶液褪色 | |
| C. | 甲烷与氯气混合光照一段时间后黄绿色褪色 | |
| D. | 乙烯在催化剂作用下生成聚乙烯 |
15.在常温下,发生下列几种反应:①16H++10Z-+2XO4-═2X2++5Z2+8H2O ②2A2++B2═2A3++2B- ③2B-+Z2═B2+2Z- 根据上述反应,判断下列结论错误的是( )
| A. | X2+是XO4-的还原产物 | |
| B. | 溶液中可发生:Z2+2A2+═2A3++2Z- | |
| C. | 氧化性强弱的顺序为:XO4->B2>Z2>A3+ | |
| D. | Z2在①中是氧化产物,③中是氧化剂 |