题目内容
无水硫酸铜在加热至650℃时开始分解生成氧化铜和气体.某活动小组通过实验,探究不同温度下气体产物的组成.实验装置如下:
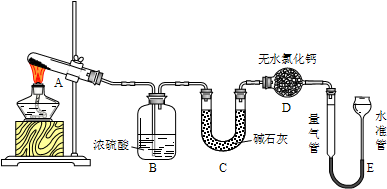
每次实验后均测定B、C质量的改变和E中收集到气体的体积.实验数据如下(E中气体体积已折算至标准状况):
(1)实验过程中A中的现象是 .D中无水氯化钙的作用是 .
(2)在测量E中气体体积时,应注意先 ,然后调节水准管与量气管的液面相平,若水准管内液面高于量气管,测得气体体积 (填“偏大”、“偏小”或“不变”).
(3)实验①中B中吸收的气体是 .实验②中E中收集到的气体是 .
(4)推测实验②中CuSO4分解反应方程式为: .
(5)根据表中数据分析,实验③中理论上C增加的质量Y3= g.
(6)结合平衡移动原理,比较T3和T4温度的高低并说明理由 .

每次实验后均测定B、C质量的改变和E中收集到气体的体积.实验数据如下(E中气体体积已折算至标准状况):
| 实验组别 | 温度 | 称取CuSO4质量/g | B增重质量/g | C增重质量/g | E中收集到气体/mL |
| ① | T1 | 0.640 | 0.320 | 0 | 0 |
| ② | T2 | 0.640 | 0 | 0.256 | V2 |
| ③ | T3 | 0.640 | 0.160 | Y3 | 22.4 |
| ④ | T4 | 0.640 | X4 | 0.192 | 33.6 |
(2)在测量E中气体体积时,应注意先
(3)实验①中B中吸收的气体是
(4)推测实验②中CuSO4分解反应方程式为:
(5)根据表中数据分析,实验③中理论上C增加的质量Y3=
(6)结合平衡移动原理,比较T3和T4温度的高低并说明理由
考点:性质实验方案的设计
专题:实验设计题
分析:(1)根据无水硫酸铜在加热至650℃时开始分解生成氧化铜和气体分析A中的现象,根据碱石灰和无水氯化钙的作用分析;
(2)气体温度较高,气体体积偏大,应注意先冷却至室温,若水准管内液面高于量气管,说明内部气压大于外界大气压,测得气体体积偏小;
(3)实验中B中浓硫酸的作用是吸收三氧化硫气体,C的作用是吸收二氧化硫,E的作用是收集到氧气;
(4)0.64g硫酸铜的物质的量为
=0.004mol,分解生成氧化铜的质量为:0.004mol×80g/mol=0.32g;SO2的质量为:0.256g,物质的量为:
=0.004mol,氧气的质量为:0.64-0.32-0.256=0.064g,物质的量为:
=0.002mol,CuSO4、CuO、SO2、O2的物质的量之比等于2:2:2;1,则实验②中CuSO4分解反应方程式为2CuSO4
2CuO+2SO2↑+O2↑;
(5)0.64g硫酸铜的物质的量为
=0.004mol,分解生成氧化铜的质量为:0.004mol×80g/mol=0.32g;SO3的质量为:0.16g,氧气的质量为:
×32=0.032g,根据质量守恒实验③中理论上C增加的质量Y3=0.64-0.32-0.16-0.032=0.128g;
(6)根据表中实验③④的数据可知,T4温度生成氧气更多,因为SO3分解为SO2和O2是吸热反应,温度高有利于生成更多的O2.
(2)气体温度较高,气体体积偏大,应注意先冷却至室温,若水准管内液面高于量气管,说明内部气压大于外界大气压,测得气体体积偏小;
(3)实验中B中浓硫酸的作用是吸收三氧化硫气体,C的作用是吸收二氧化硫,E的作用是收集到氧气;
(4)0.64g硫酸铜的物质的量为
| 0.64g |
| 160g/mol |
| 0.256g |
| 64g/mol |
| 0.064g |
| 32g/mol |
| ||
(5)0.64g硫酸铜的物质的量为
| 0.64g |
| 160g/mol |
| 0.0224 |
| 22.4 |
(6)根据表中实验③④的数据可知,T4温度生成氧气更多,因为SO3分解为SO2和O2是吸热反应,温度高有利于生成更多的O2.
解答:
解:(1)因为无水硫酸铜在加热至650℃时开始分解生成氧化铜和气体,故实验过程中A中的现象是白色固体变黑,因为碱石灰能够吸水,D中无水氯化钙的作用是 吸收水蒸气,防止装置E中的水进入装置C,影响C的质量变化,故答案为:白色固体变黑;吸收水蒸气,防止影响C的质量变化;
(2)加热条件下,气体温度较高,在测量E中气体体积时,应注意先冷却至室温,若水准管内液面高于量气管,说明内部气压大于外界大气压,测得气体体积偏小,故答案为:冷却至室温 偏小;
(3)实验中B中浓硫酸的作用是吸收三氧化硫气体,C的作用是吸收二氧化硫,E的作用是收集到氧气,故答案为:SO3;O2;
(4)0.64g硫酸铜的物质的量为
=0.004mol,分解生成氧化铜的质量为:0.004mol×80g/mol=0.32g;SO2的质量为:0.256g,物质的量为:
=0.004mol,氧气的质量为:0.64-0.32-0.256=0.064g,物质的量为:
=0.002mol,CuSO4、CuO、SO2、O2的物质的量之比等于2:2:2;1,则实验②中CuSO4分解反应方程式为2CuSO4
2CuO+2SO2↑+O2↑,故答案为:2CuSO4
2CuO+2SO2↑+O2↑;
(5)0.64g硫酸铜的物质的量为
=0.004mol,分解生成氧化铜的质量为:0.004mol×80g/mol=0.32g;SO3的质量为:0.16g,氧气的质量为:
×32=0.032g,实验③中理论上C增加的质量Y3=0.64-0.32-0.16-0.032=0.128g.故答案为:0.128;
(6)根据表中实验③④的数据可知,T4温度生成氧气更多,因为SO3分解为SO2和O2是吸热反应,温度高有利于生成更多的O2,故T4温度更高,故答案为:T4温度更高,因为SO3分解为SO2和O2是吸热反应,温度高有利于生成更多的O2.
(2)加热条件下,气体温度较高,在测量E中气体体积时,应注意先冷却至室温,若水准管内液面高于量气管,说明内部气压大于外界大气压,测得气体体积偏小,故答案为:冷却至室温 偏小;
(3)实验中B中浓硫酸的作用是吸收三氧化硫气体,C的作用是吸收二氧化硫,E的作用是收集到氧气,故答案为:SO3;O2;
(4)0.64g硫酸铜的物质的量为
| 0.64g |
| 160g/mol |
| 0.256g |
| 64g/mol |
| 0.064g |
| 32g/mol |
| ||
| ||
(5)0.64g硫酸铜的物质的量为
| 0.64g |
| 160g/mol |
| 0.0224 |
| 22.4 |
(6)根据表中实验③④的数据可知,T4温度生成氧气更多,因为SO3分解为SO2和O2是吸热反应,温度高有利于生成更多的O2,故T4温度更高,故答案为:T4温度更高,因为SO3分解为SO2和O2是吸热反应,温度高有利于生成更多的O2.
点评:本题考查物质的组成和实验数据的处理,做题时注意把握实验基础知识,充分利用有关数据进行计算,本题具有一定难度.

练习册系列答案
相关题目
 (1)用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧的热化学方程式
(1)用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧的热化学方程式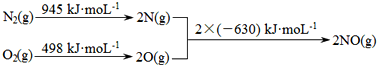
 北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体.火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体.火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题: