题目内容
铁的氢氧化物有 和 ,两者均 溶于水.其中 为白色,露置在空气中易被氧化,反应方程式为 ,反应现象为:白色先变成 色,最终变为 色.将该物质溶于盐酸,得到 色溶液,有关反应方程式为 .在该溶液中加入足量铁粉,溶液变为 色,有关反应的离子方程式为 .
考点:铁的氧化物和氢氧化物,铁的化学性质
专题:几种重要的金属及其化合物
分析:铁的氢氧化物有氢氧化铁和氢氧化亚铁,二者都不溶于水,氢氧化铁为红褐色沉淀,氢氧化亚铁为白色沉淀;氢氧化亚铁在空气中容易被氧化,最终能够变成红褐色的氢氧化铁;氢氧化铁与盐酸反应生成氯化铁和水,氯化铁溶液为棕黄色溶液;铁离子与铁粉反应生成亚铁离子,溶液变成浅绿色,据此写出反应的离子方程式.
解答:
解:Fe的氢氧化物有两种,分别为 红褐色的Fe(OH)3和白色的Fe(OH)2,氢氧化铁和氢氧化亚铁都不溶于水;Fe(OH)2为白色,在空气中很容易被被氧化,反应现象为:先变成灰绿色,最终变成红褐色,反应的离子方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;氢氧化铁能够与盐酸反应生成氯化铁和水,溶液变成棕黄色,反应的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O;氯化铁溶液中加入铁粉,铁离子能够与铁粉反应生成亚铁离子,溶液变成浅绿色,反应的离子方程式为:2Fe3++Fe═3Fe2+,
故答案为:Fe(OH)3;Fe(OH)2;不;Fe(OH)2;4Fe(OH)2+O2+2H2O═4Fe(OH)3;灰绿色;红褐色;棕黄色;Fe(OH)3+3H+=Fe3++3H2O;浅绿色;2Fe3++Fe═3Fe2+.
故答案为:Fe(OH)3;Fe(OH)2;不;Fe(OH)2;4Fe(OH)2+O2+2H2O═4Fe(OH)3;灰绿色;红褐色;棕黄色;Fe(OH)3+3H+=Fe3++3H2O;浅绿色;2Fe3++Fe═3Fe2+.
点评:本题考查了铁的化合物的性质,题目难度不大,注意掌握铁及其化合物的性质,明确氢氧化亚铁、氢氧化铁的颜色及化学性质,熟悉氢氧化亚铁转化成氢氧化铁的反应方程式、反应现象.

练习册系列答案
相关题目
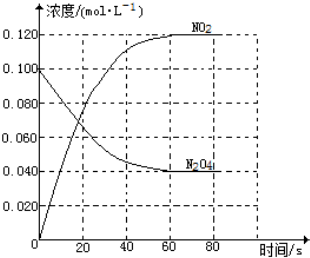 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度的升高,混合气体的颜色变深.
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度的升高,混合气体的颜色变深.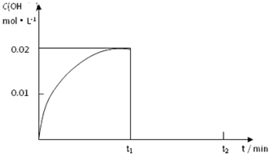 I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g)
I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g)
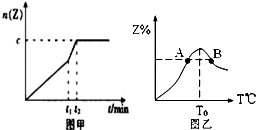 在一个体积为2L的恒容密闭容器中通入2molX(g)和1molY(g),发生反应:2X(g)+Y(g)?2Z(g);△H<0
在一个体积为2L的恒容密闭容器中通入2molX(g)和1molY(g),发生反应:2X(g)+Y(g)?2Z(g);△H<0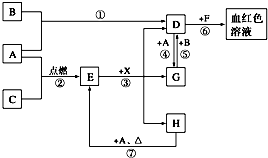 A、B、C为中学常见单质,其中一种为金属,通常情况下,A为固体,B为黄绿色气体,C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体.它们之间的转化关系如下图所示(其中某些反应条件和部分反应物已略去).
A、B、C为中学常见单质,其中一种为金属,通常情况下,A为固体,B为黄绿色气体,C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体.它们之间的转化关系如下图所示(其中某些反应条件和部分反应物已略去).