题目内容
 (1)用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧的热化学方程式
(1)用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧的热化学方程式(2)化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1 mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ?mol-1 | 197 | 360 | 499 | X |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:(1)依据质量换算物质的量,结合化学方程式对应的物质的量计算反应放出的热量,依据热化学方程式书写方法,标注物质聚集状态和反应焓变写出;已知1mol液态水汽化时需要吸收44kJ热量,依据热化学方程式和盖斯定律计算得到;
(2)白磷燃烧的方程式为P4+5O2=P4O10,根据化学键的断裂和形成的数目进行计算.
(2)白磷燃烧的方程式为P4+5O2=P4O10,根据化学键的断裂和形成的数目进行计算.
解答:
解:(1)当10kg丁烷完全反应物质的量
=
=mol,完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,2mol丁烷完全反应放热=
=5800KJ,依据反应物和产物状态标注聚集状态和对应量下的反应热,书写的热化学方程式为:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5800kJ/mol;
已知1mol液态水汽化时需要吸收44kJ热量,①H2O(l)=H2O(g)△H=44KJ/mol;②2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5800kJ/mol;
依据盖斯定律①×10+②得到2C4H10(g)+13O2(g)=8CO2(g)+10H2O(g)△H=-5360kJ/mol,所以1mol丁烷完全燃烧生成二氧化碳和水蒸汽时放热2680KJ,
故答案为:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5800kJ/mol;-2680KJ/mol;
(2)白磷燃烧的方程式为P4+5O2=P4O10,1mol白磷完全燃烧需拆开6mol P-P、5mol O=O,形成12molP-O、4mol P=O,
所以12mol×360kJ/mol+4mol×xkJ/mol-(6mol×197 kJ/mol+5 mol×499 kJ/mol)=2378.0kJ,
x=433.75≈434.
故答案为:434.
| 10000g |
| 58g?mol-1 |
| 10000 |
| 58 |
| 2×5×10-5 | ||
|
已知1mol液态水汽化时需要吸收44kJ热量,①H2O(l)=H2O(g)△H=44KJ/mol;②2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5800kJ/mol;
依据盖斯定律①×10+②得到2C4H10(g)+13O2(g)=8CO2(g)+10H2O(g)△H=-5360kJ/mol,所以1mol丁烷完全燃烧生成二氧化碳和水蒸汽时放热2680KJ,
故答案为:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5800kJ/mol;-2680KJ/mol;
(2)白磷燃烧的方程式为P4+5O2=P4O10,1mol白磷完全燃烧需拆开6mol P-P、5mol O=O,形成12molP-O、4mol P=O,
所以12mol×360kJ/mol+4mol×xkJ/mol-(6mol×197 kJ/mol+5 mol×499 kJ/mol)=2378.0kJ,
x=433.75≈434.
故答案为:434.
点评:本题考查较为综合,题目难度中等,本题注意热化学方程式的书写方法和计算应用,注意焓变计算和物质聚集状态的标注,学习中要准确把握,另外注意反应热的计算,特别是注意分析白磷的氧化磷的分子结构,正确判断共价键的类型和数目.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列装置烧杯中盛放的都是稀硫酸,在铜上能产生大量气泡的是( )
A、 |
B、 |
C、 |
D、 |
我国政府已启动“酱油补铁工程”.这里的铁指的是( )
| A、铁元素 | B、铁单质 |
| C、四氧化三铁 | D、硫酸铁 |
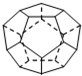 (1)德国和美国科学家首先制出由20个碳原子组成的 空心笼状分子C20,该笼状结构是由许多正五边形构成 (如图所示).请回答:C20分子共有
(1)德国和美国科学家首先制出由20个碳原子组成的 空心笼状分子C20,该笼状结构是由许多正五边形构成 (如图所示).请回答:C20分子共有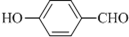 的沸点比
的沸点比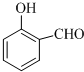 高,其原因是
高,其原因是