题目内容
现有0.27kg质量分数为10%CuCl2溶液,测得其密度为1.08g/cm3.试计算:
(1)溶液中氯化铜的物质的量;
(2)溶液中氯离子的物质的量浓度;
(3)为使这些铜离子完全沉淀,需要加入1mol/L的NaOH溶液的体积是多少?
(1)溶液中氯化铜的物质的量;
(2)溶液中氯离子的物质的量浓度;
(3)为使这些铜离子完全沉淀,需要加入1mol/L的NaOH溶液的体积是多少?
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:(1)根据m(溶质)=m(溶液)w(溶质)计算CuCl2的质量,再根据n=
计算CuCl2的物质的量;
(2)根据V=
计算溶液的体积,溶液中n(Cl-)=2n(CuCl2),再根据c=
计算氯离子物质的量浓度;
(3)发生反应Cu2++2OH-=Cu(OH)2↓,据此计算NaOH的物质的量,再根据V=
计算需要氢氧化钠的体积.
| m |
| M |
(2)根据V=
| m |
| ρ |
| n |
| V |
(3)发生反应Cu2++2OH-=Cu(OH)2↓,据此计算NaOH的物质的量,再根据V=
| n |
| c |
解答:
解:(1)氯化铜的质量=270g×10%=27g,故CuCl2的物质的量=
=0.2mol,
答:溶液中氯化铜的物质的量为0.2mol.
(2)溶液的体积=
=0.25L,溶液中n(Cl-)=2n(CuCl2)=0.2mol×2=0.4mol,氯离子物质的量浓度=
=1.6mol/L,
答:溶液中氯离子浓度为1.6mol/L.
(3)发生反应Cu2++2OH-=Cu(OH)2↓,由方程式可知需要NaOH的物质的量=0.2mol×2=0.4mol,故需要氢氧化钠的体积=
=0.4L,
答:需要1mol/L氢氧化钠溶液的体积0.4L.
| 27g |
| 135g/mol |
答:溶液中氯化铜的物质的量为0.2mol.
(2)溶液的体积=
| 270g |
| 1080g/L |
| 0.4mol |
| 0.25L |
答:溶液中氯离子浓度为1.6mol/L.
(3)发生反应Cu2++2OH-=Cu(OH)2↓,由方程式可知需要NaOH的物质的量=0.2mol×2=0.4mol,故需要氢氧化钠的体积=
| 0.4mol |
| 1mol/L |
答:需要1mol/L氢氧化钠溶液的体积0.4L.
点评:本题考查物质的量浓度、质量分数有关计算,比较基础,侧重对基础知识的巩固.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
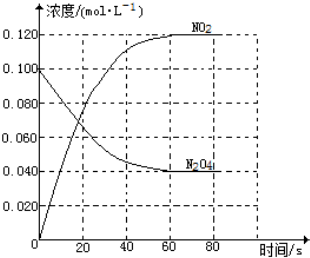 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度的升高,混合气体的颜色变深.
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度的升高,混合气体的颜色变深.