题目内容
5.今有0.1mol/L NaCl溶液300mL,0.1mol/L MgCl2溶液200mL和0.1mol/LAlCl3溶液100mL,这三种溶液中氯离子浓度之比是1:2:3.分析 离子浓度为溶质浓度与氯离子个数的积,以此来解答.
解答 解:0.1mol/L NaCl溶液300mL中氯离子浓度为0.1mol/L,
0.1mol/L MgCl2溶液200mL中氯离子浓度为0.1mol×2=0.2mol/L,
0.1mol/LAlCl3溶液100mL中氯离子浓度为0.1mol×3=0.3mol/L,
这三种溶液中氯离子浓度之比是1:2:3,
故答案为:1:2:3.
点评 本题考查物质的量浓度的计算,为高频考点,把握溶质浓度与离子浓度的关系为解答的关键,侧重分析与计算能力的考查,注意离子浓度与溶液体积无关,题目难度不大.

练习册系列答案
相关题目
15.某研究小组向某2L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)?D(g)+E(g)△H=QkJ•mol-1.在T1℃时,反应进行到不同时间测得各物质的物质的量如表:
(1)T1℃时,该反应的平衡常数K=0.25;
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是ae(填字母编号).
a.通入一定量的B b.加入一定量的固体A c.适当缩小容器的体积
d.升高反应体系温度 e.同时加入0.2molB、0.1molD、0.1molE
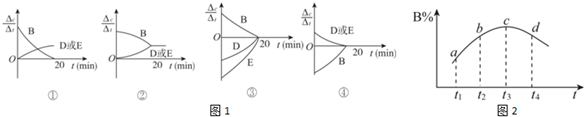
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为图1中的④(填序号).
(4)维持容器的体积和温度T1不变,当向该容器中加入1.60 mol B、0.20 mol D、0.20 mol E和nmolA,达到平衡后,与表格中20分钟时各物质的浓度完全相同时,则投入固体A的物质的量n的取值范围是>0.3.
(5)维持容器的体积和温度T1不变,各物质的起始物质的量为n(A)=1.0 mol,n(B)=3.0 mol,n(D)=a mol,达到平衡后,n(E)=0.50 mol,则a=1.5.
(6)若该密闭容器绝热,实验测得B的转化率B%随时间变化的示意图如图2所示.由图可知,Q小于0(填“大于”或“小于”),c点v正等于v逆(填“大于”“小于”或“等于”).
| 时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
| B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
| D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
| E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是ae(填字母编号).
a.通入一定量的B b.加入一定量的固体A c.适当缩小容器的体积
d.升高反应体系温度 e.同时加入0.2molB、0.1molD、0.1molE
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为图1中的④(填序号).

(4)维持容器的体积和温度T1不变,当向该容器中加入1.60 mol B、0.20 mol D、0.20 mol E和nmolA,达到平衡后,与表格中20分钟时各物质的浓度完全相同时,则投入固体A的物质的量n的取值范围是>0.3.
(5)维持容器的体积和温度T1不变,各物质的起始物质的量为n(A)=1.0 mol,n(B)=3.0 mol,n(D)=a mol,达到平衡后,n(E)=0.50 mol,则a=1.5.
(6)若该密闭容器绝热,实验测得B的转化率B%随时间变化的示意图如图2所示.由图可知,Q小于0(填“大于”或“小于”),c点v正等于v逆(填“大于”“小于”或“等于”).
16.已知热化学方程式:
S(s)+O2(g)═SO2(g)△H1
S(g)+O2(g)═SO2(g)△H2
2H2(g)+O2(g)═2H2O(g)△H3
2H2(g)+O2(g)═2H2O(l)△H4.
下列大小关系正确的是( )
S(s)+O2(g)═SO2(g)△H1
S(g)+O2(g)═SO2(g)△H2
2H2(g)+O2(g)═2H2O(g)△H3
2H2(g)+O2(g)═2H2O(l)△H4.
下列大小关系正确的是( )
| A. | △H2>△H1,△H4>△H3 | B. | △H1>△H2,△H4>△H3 | C. | △H1>△H2,△H3>△H4 | D. | △H2>△H1,△H3>△H4 |
20.下列反应既是氧化还原反应又是离子反应的是( )
| A. | 钠在氯气中燃烧 | B. | 二氧化碳通入澄清的石灰水中 | ||
| C. | 氯化钠溶液中滴加硝酸银溶液 | D. | 锌粒放入稀硫酸中 |
10.某有机物的结构简式如图所示,有关该有机物的叙述正确的是( )
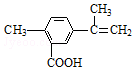

| A. | 在一定条件下,能发生取代、氧化、水解、酯化和加聚反应 | |
| B. | 该物质分子中最多可以有9个碳原子在同一平面上 | |
| C. | 1 mol该物质最多可与5mol H2发生加成反应 | |
| D. | 1 mol该物质完全氧化最多可消耗13 mol氧气 |
17.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1L pH=l的硫酸溶液中含有的H+数目为0.2NA | |
| B. | 1 mol羟基与l mol氢氧根离子所含质子数均为9NA | |
| C. | 14 g由N2与CO组成的混合气体中含有的原子数目为2NA | |
| D. | 标准状况下,2.24 L Cl2溶于水,转移的电子数目为0.1NA |
14.有关水在人体中的作用,下列说法不正确的是( )
| A. | 水是一种很好的溶剂 | B. | 水在人体内还有调节体温的作用 | ||
| C. | 饮用水越纯净对身体越好 | D. | 水是反应介质和反应物 |
15.下列各组中的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A. | Cu(OH)2+HC1; Cu(OH)2+CH3COOH | B. | NaHCO3+H2SO4;Na2CO3+HCl | ||
| C. | NaHS04+NaOH; H2SO4+NaOH | D. | BaCl2与 Na2SO4;Ba(OH)2 与 CuSO4 |