题目内容
下列说法正确的是
①已知BaSO4的Ksp=C(Ba2+)·C(SO42-),所以在硫酸钡溶液中有C(Ba2+)=C(SO42-)=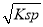 mol/L;
mol/L;
②常温下,强酸溶液的PH=a,将溶液的体积稀释到原来的10n倍,则PH=a+n;
③将0.1mol/L的NaHS和0.1mol/L的Na2S溶液等体积混合,所得溶液中有C(S2-)+2C(OH-)=2C(H+)+C(HS-)+3C(H2S);
④在0.1mol/L氨水中滴加0.1mol/L盐酸,恰好中和时PH=a,则由水电离产生的C(OH-)=10-amol/L
A.①④ B.②③ C.③④ D.①②
C
【解析】
试题分析:①在硫酸钡溶液中,钡离子的浓度与硫酸根离子的浓度不相等,错误;②如果无限稀释,PH=7。不在等于a+n ,B错误;③将0.1mol/L的NaHS和0.1mol/L的Na2S溶液等体积混合,根据电荷守恒和物料守恒,所得溶液中有C(S2-)+2C(OH-)=2C(H+)+C(HS-)+3C(H2S),正确; ④在0.1mol/L氨水中滴加0.1mol/L盐酸,恰好中和时,生成了强酸弱碱盐,显酸性,PH=a,则由水电离产生的C(OH-)=10-amol/L,正确,选C。
考点:考查沉淀溶解平衡,溶液的稀释,离子浓度关系等知识。

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案(5分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c1 | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸: 。
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2 mol·L-1? (选填“是”或“否”)。
(3)从丙组实验结果分析,HA是 酸(选填“强”或“弱”)。
(4)写出丁组实验所得混合溶液中下列算式的精确结果(不能做近似计算)。
①c(Na+)-c(A-)= mol·L-1;
②c(OH-)-c(HA)= mol·L-1。

