题目内容
17.在硫酸铁溶液中,加入ag铜完全溶解后再加入bg铁,充分反应后得到cg残余固体,且a>c,则下列说法中正确的是( )| A. | 残余固体可能为铁和铜的混合物 | |
| B. | 最后得到的溶液可能含有Fe3+ | |
| C. | 残余固体是铁,溶液中一定不含Cu2+ | |
| D. | 残余固体一定全部是铜 |
分析 发生的反应有:2Fe3++Cu=2Fe2++Cu2+、Cu2++Fe=Cu+Fe2+,a>c,说明铜没有被完全置换出,以此来解答.
解答 解:a>c,说明铜没有被完全置换出,cg固体为Cu;
则溶液中一定存在Cu2+,
铜有剩余,由2Fe3++Cu=2Fe2++Cu2+可知一定不存在Fe3+,
故选D.
点评 本题考查金属及化合物的性质,为高频考点,把握发生的反应、固体的成分为解答的关键,侧重分析与计算能力的考查,注意氧化还原反应的应用,题目难度不大.

练习册系列答案
相关题目
7.下列醇中既能发生消去反应,又能被氧化为醛的是( )
① ②
② ③CH3OH④
③CH3OH④
⑤ ⑥
⑥
①
 ②
② ③CH3OH④
③CH3OH④
⑤
 ⑥
⑥
| A. | ①④⑤ | B. | ④ | C. | ②⑥ | D. | ①②⑥ |
8.某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体配制480mL含NaClO25%,密度为1.19g/cm3的消毒液.下列说法正确的是( )
| A. | 配制过程只需要三种仪器即可完成 | |
| B. | 容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制 | |
| C. | 所配得的NaClO消毒液物质的量浓度为3.99mol/L | |
| D. | 需要称量的NaClO固体的质量为140g |
5.下列离子检验的方法正确的是( )
| A. | 向某无色溶液中加入BaCl2溶液,产生不溶于稀HNO3的白色沉淀,说明原溶液中一定有SO42- | |
| B. | 向某无色溶液中加入盐酸,有无色、无味的气体产生,说明原溶液中一定有CO32- | |
| C. | 灼烧某白色粉末,火焰呈黄色,说明原粉末中有Na+,无K+ | |
| D. | 向某溶液中滴加硫氰化钾溶液,溶液不变红,再滴加氯水,溶液变红,说明原溶液一定有Fe2+ |
12.下列有关化学用语表达正确的是( )
| A. | 35Cl-和37Cl-离子结构示意图均可以表示为: | |
| B. | HClO的结构式:H-Cl-O | |
| C. | HF的电子式: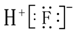 | |
| D. | 质子数为92、中子数为146的U原子:14692U |
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1mol的氢氧根离子中的电子数目约为9NA | |
| B. | 56 g铁片投入足量稀H2SO4中生成NA个SO2分子 | |
| C. | 标准状况下,11.2 L NH3中含有分子的数目为0.5NA | |
| D. | 在铜与足量稀硝酸的反应中,每生成0.1 mol气体,转移电子的数目为0.2NA |
9.下列说法正确的是( )
| A. | 地下钢管连接锌板属于牺牲阳极的阴极保护法 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 化学平衡发生移动,平衡常数一定发生改变 | |
| D. | 强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱 |
6.下列电离方程式中,正确的是( )
| A. | H2SO4═H2++SO42- | B. | Ba(OH)2═Ba2++OH- | ||
| C. | NH4NO3═NH4++NO3- | D. | 2KClO3═2K++2Cl-+3O2- |
7.下列是某学生自己总结的一些规律,其中正确的是( )
| A. | 所有元素都有同位素 | |
| B. | 有的无机化学反应不属于化合、分解、置换、复分解中的任何一种反应 | |
| C. | 一种元素在同一物质中可显示不同价态,但一定是该元素的相邻价态 | |
| D. | 氧化物只可能是氧化产物,不可能是还原产物 |