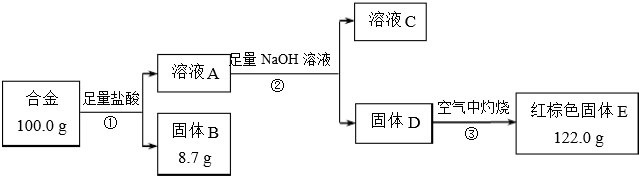
题目内容
5.下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是( )| A. | H2SO4、K、HCl | B. | Cl2、Al、H2 | C. | NO2、Na、Br2 | D. | O2、SO2、H2O |
分析 一般来说,元素化合价为最高价态,应具有氧化性,元素化合价为最低价态,则只具有还原性,化合价处于中间价态,则既有氧化性又有还原性.
解答 解:A.H2SO4中H、S为最高价态,只具有氧化性,K为最低价态,只具有还原性,HCl中H元素化合价为+1价,具有氧化性,Cl元素化合价为-1价,具有还原性,故A正确;
B.氯气中Cl元素化合价为0价,处于中间价态,既有氧化性又有还原性,氢气只具有还原性,故B错误;
C.NO2中N元素化合价为+4价,处于中间价态,既有氧化性又有还原性,故C错误;
D.SO2中S元素化合价为+4价,处于中间价态,既有氧化性又有还原性,故D错误.
故选A.
点评 本题考查氧化还原反应,为高频考点和常见题型,侧重于学生的分析能力的考查,本题侧重于从化合价的价态判断物质可能具有的性质,注意把握氧化还原反应中化合价的变化特点,难度不大.

练习册系列答案
相关题目
13.短周期主族元素X、Y、Z、M、N的原子序数依次增大.X和M的原子核外均有两个未成对电子,但不处于同一主族.Y、Z、M最高价氧化物对应的水化物两两之间能相互反应,N和M相邻.下列叙述正确的是( )
| A. | 原子最外层电子数由少到多的顺序:Y、Z、X、M、N | |
| B. | 单质Y的熔点高于单质Z的熔点 | |
| C. | 元素非金属性由弱到强的顺序:M、N、X | |
| D. | 电解N和Y、Z形成的化合物可分别得到对应的Y和Z |
20.物质的量均为0.1mol的A1C13、CuC12和H2SO4溶于水制成100mL的混合溶液,用石墨作电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同,则下列描述正确的是( )
| A. | 电路中共转移0.7mol电子 | |
| B. | 阴极得到的气体物质的量为0.35mol | |
| C. | 阴极质量增加3.2g | |
| D. | 铝元素以A1(OH)3的形式存在 |
10.下列每组反应一定能用同一离子方程式表示的是( )
| A. | CuO分别与稀硫酸、稀盐酸反应 | |
| B. | CaCO3、Na2CO3分别与盐酸反应 | |
| C. | H2SO4、K2SO4溶液分别与Ba(OH)2溶液反应 | |
| D. | Na分别与水、稀盐酸反应 |
17.已知草酸镍晶体(NiC2O4•2H2O)难溶于水,工业上从废镍催化剂(成分主 要是Ni,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
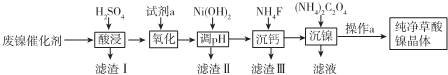
已知:①相关金属离子生成氢氧化物沉淀的pH如表:
②Ksp(CaF2)=1.46×10-10
③当某物质模拟高度小于1.0×10-5mol.L-1时,视为完全沉淀.
(1)请写出一种能提高酸浸速率的措施把废镍催化剂粉碎或适当加热、适当增大硫酸浓度、搅拌等.
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)pH的调控范围为5.0~6.8,试用化学反应原理的相关知识解释滤渣Ⅱ的生成.5.6~6.8
(4)写出“沉镍”时反应的离子方程式Ni2++C2O42-+2H2O=NiC2O4•2H2O,证明Ni2+已经沉淀完全的实验步骤及现象是取上层清液,继续滴加(NH4)2C2O4溶液,无沉淀生成,
(5)操作a的内容为过滤、洗涤、干燥.

已知:①相关金属离子生成氢氧化物沉淀的pH如表:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
| 完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
③当某物质模拟高度小于1.0×10-5mol.L-1时,视为完全沉淀.
(1)请写出一种能提高酸浸速率的措施把废镍催化剂粉碎或适当加热、适当增大硫酸浓度、搅拌等.
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)pH的调控范围为5.0~6.8,试用化学反应原理的相关知识解释滤渣Ⅱ的生成.5.6~6.8
(4)写出“沉镍”时反应的离子方程式Ni2++C2O42-+2H2O=NiC2O4•2H2O,证明Ni2+已经沉淀完全的实验步骤及现象是取上层清液,继续滴加(NH4)2C2O4溶液,无沉淀生成,
(5)操作a的内容为过滤、洗涤、干燥.
14.一块质量为0.92g金属钠投入到100ml物质的量浓度0.1mol/l的AlCl3溶液中,反应得到的生成物是( )
| A. | H2、Al(OH)3 | B. | H2、NaAlO2 | C. | H2、NaAlO2、NaCl | D. | H2、Al(OH)3、NaCl |