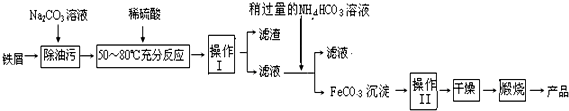
题目内容
6.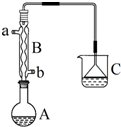 正溴丁烷(CH3CH2CH2CH2Br)是一种重要的有机合成工业原料.在实验中可利用下图装置(加热或夹持装置省略)制备正溴丁烷.制备时的化学反应方程式及有关数据如下:
正溴丁烷(CH3CH2CH2CH2Br)是一种重要的有机合成工业原料.在实验中可利用下图装置(加热或夹持装置省略)制备正溴丁烷.制备时的化学反应方程式及有关数据如下:NaBr+H2SO4═HBr+NaHSO4
C4H9OH+HBr$\stackrel{浓硫酸}{→}$C4H9Br+H2O
| 物质 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 水中溶解性 |
| 正丁醇 | 74 | 0.80 | 117.3 | 微溶 |
| 正溴丁烷 | 137 | 1.27 | 101.6 | 难溶 |
| 溴化氢 | 81 | --- | --- | 极易溶解 |
请回答下列问题:
(1)仪器A的名称是圆底烧瓶,仪器B的作用是冷却、回流;操作中加入沸石的作用是防止暴沸.
(2)装置C中盛装的液体是NaOH溶液,装置C中倒立的漏斗作用是防止倒吸.
(3)制备的粗产物正溴丁烷中往往含有水分、正丁醇等杂质,加入干燥剂出去水分后,再由下列操作中的d制备纯净的正溴丁烷.
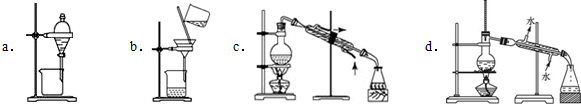
(4)若制备实验的“回流”过程中不采用“调节为小火”,仍采用大火加热回流,则会使产品产率偏低(填“高”或“低”),试说出其中一种原因:大火,副反应多或产物逸出较多.
(5)若最终得到13.7g纯净的正溴丁烷,则该实验的产率是50%.
分析 (1)根据仪器的结构确定仪器的名称;正丁醇易挥发,通过球形冷凝管冷凝、回流,提高原料的利用率;液体加热时,需要加碎瓷片,防止暴沸;
(2)在此反应过程中生成了溴化氢气体,会对环境产生污染,故需用碱液进行吸收;
(3)正溴丁烷中含有正丁醇杂质,这两种液体是相互溶解的有机物,只能采用蒸馏的方法进行分离;
(4)如果采用大火加热回流时,在较高的温度下会发生很多其他的副反应,如浓硫酸在温度较高的情况下氧化性更强,可能会把乙醇等有机物氧化,正丁醇和正丁烷的沸点都比较低,易逸出等都会使产率降低.
(5)先根据方程式C4H9OH+HBr$\stackrel{浓硫酸}{→}$C4H9Br+H2O计算出C4H9Br的理论值,然后用实际值除以理论值即产率;
解答 解:(1)仪器A的名称是圆底烧瓶;正丁醇易挥发,通过球形冷凝管冷凝、回流,提高原料的利用率;
操作中加入沸石的作用是防止暴沸;
故答案为:圆底烧瓶;冷却、回流;防止暴沸;
(2)反应过程中生成了溴化氢气体,会对环境产生污染,可通过NaOH溶液进行吸收;
由于HBr与氢氧化钠溶液迅速反应,容易产生倒吸现象,所以装置C中倒立的漏斗的作用是可防止倒吸,
故答案为:NaOH溶液;防止倒吸;
(3)正溴丁烷中含有正丁醇杂质,这两种液体相互溶解,只能采用蒸馏的方法进行分离;
故答案为:d;
(4)如果采用大火加热回流时,在较高的温度下会发生很多其他的副反应,如浓硫酸在温度较高的情况下氧化性更强,可能会把乙醇等有机物氧化,正丁醇和正丁烷的沸点都比较低,易逸出等都会使产率降低.
故答案为:低;大火,副反应多或产物逸出较多;
(5)m(C4H9OH )=18.5mL×0.80g•cm-3=14.8g,则n(C4H9OH )=$\frac{14.8g}{74g/mol}$=0.2mol,
C4H9OH+HBr$\stackrel{浓硫酸}{→}$C4H9Br+H2O
1mol 1mol
2mol 0.2mol
所以m(C4H9 Br)=0.2mol×137g/mol=27.4g,产率为:$\frac{13.7g}{27.4g}$×100%=50%;
故答案为:50%%.
点评 本题以正丁醇制备正溴丁烷为背景,考查物质的分离提纯、性质实验方案设计、仪器的作用、化学计算等知识,题目难度中等,明确实验目的、实验原理为解答关键,试题培养了学生的分析、理解能力及化学实验能力.

 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案| A. | 丙醛 | B. | 丙烯醛 | C. | 甲醛 | D. | 丁烯醛 |
| A. | CH4、C2H4、C3H4 | |
| B. | CH4、C3H8、C2H2(C2H8、C2H2物质的量之比为1:3) | |
| C. | C2H6、C4H6、C2H2(物质的量之比为2:1:2) | |
| D. | C3H8、C4H8、C2H2(质量之比为11:14:26) |
| A. | 转移时没有洗涤2~3次 | |
| B. | 定容时,俯视液面使之与刻度线相平 | |
| C. | 溶解时放出了大量的热,但未等温度恢复为常温就开始转移 | |
| D. | 转移溶液前,容量瓶不干燥,留下少量的水 |
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3-[] | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5[] | 3×10-5 | 2×10-5 |
(2)NOx是汽车尾气的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
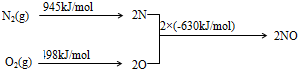
①N2(g)+O2(g)?2NO(g)△H=+183 kJ•moL-1.
②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出.写出NO被CO还原的化学方程式2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$ 2CO2+N2.
③汽车汽油不完全燃烧时还产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g),已知该反应的△H>0,该设想能否实现?不能.你的依据是该反应是熵减、焓增的反应,任何温度下均不能自发进行.
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
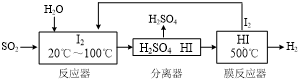
①用离子方程式表示反应器中发生的反应SO2+I2+2H2O=SO42-+2I-+4H+.
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行.
③用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池.电池充放电时的总反应为:Ni(OH)2+M?充电放电NiO(OH)+MH,电池放电时,负极电极反应式为MH+OH--e-=H2O+M; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为4O2+4e-+2H2O=4OH-.
| A. | SO2具有漂白性,能使滴有酚酞的NaOH溶液褪色 | |
| B. | Na2O2与水和二氧化碳反应都会生成氧气,可用作供氧剂 | |
| C. | MgO、Al2O3熔点高,可用于耐高温材料 | |
| D. | 常温下,铝与浓硝酸发生钝化,可用铝槽车贮运浓硝酸 |
 图中A、B、C、D是同周期或同主族的相邻元素:
图中A、B、C、D是同周期或同主族的相邻元素: