题目内容
11.配制一定物质的量浓度的溶液时,如果所配溶液浓度偏小,原因可能是( )| A. | 转移时没有洗涤2~3次 | |
| B. | 定容时,俯视液面使之与刻度线相平 | |
| C. | 溶解时放出了大量的热,但未等温度恢复为常温就开始转移 | |
| D. | 转移溶液前,容量瓶不干燥,留下少量的水 |
分析 根据c=$\frac{n}{V}$c=可知,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化;若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.
解答 解:A.没有洗涤烧杯和玻璃棒,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故A正确;
B.定容时,俯视液面使之与刻度线相平,导致加入的蒸馏水体积偏小,配制的溶液浓度偏高,故B错误;
C.溶解时放出了大量的热,但未等温度恢复为常温就开始转移,导致配制的溶液体积偏小,溶液浓度偏高,故C错误;
D.容量瓶中有少量水,对溶液中的物质的量及最终溶液体积无影响,则不影响配制结果,故D错误;
故选A.
点评 本题考查了溶液配制过程中的误差分析,题目难度中等,明确配制方法为解答关键,注意判断误差时根据实验操作对根据c=$\frac{n}{V}$c=产生的影响进行分析,试题培养了学生的化学实验能力.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
6.有以下六种溶液:①Ba(OH)2溶液;②Ba(NO3)2溶液;③KMnO4溶液;④品红试液;⑤Na2SiO3溶液;⑥NaHCO3溶液,可用于区分CO2和SO2这两种气体的有( )种.
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
6.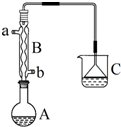 正溴丁烷(CH3CH2CH2CH2Br)是一种重要的有机合成工业原料.在实验中可利用下图装置(加热或夹持装置省略)制备正溴丁烷.制备时的化学反应方程式及有关数据如下:
正溴丁烷(CH3CH2CH2CH2Br)是一种重要的有机合成工业原料.在实验中可利用下图装置(加热或夹持装置省略)制备正溴丁烷.制备时的化学反应方程式及有关数据如下:
NaBr+H2SO4═HBr+NaHSO4
C4H9OH+HBr$\stackrel{浓硫酸}{→}$C4H9Br+H2O
实验步骤:在装置A中加入2mL水,并小心加入28mL浓硫酸,混合均匀后冷却至室温.再依次加入18.5mL正丁醇和26g溴化钠,充分摇振后加入沸石,连接气体吸收装置C.将装置A置于石棉网上加热至沸腾,然后调节为小火使反应物保持平稳地回流.一段时间后停止加热,待反应液冷却后,拆去装置B,改为蒸馏装置,蒸出粗正溴丁烷.
请回答下列问题:
(1)仪器A的名称是圆底烧瓶,仪器B的作用是冷却、回流;操作中加入沸石的作用是防止暴沸.
(2)装置C中盛装的液体是NaOH溶液,装置C中倒立的漏斗作用是防止倒吸.
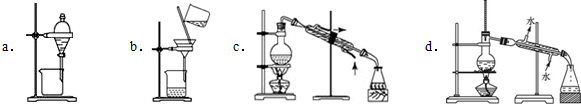
(3)制备的粗产物正溴丁烷中往往含有水分、正丁醇等杂质,加入干燥剂出去水分后,再由下列操作中的d制备纯净的正溴丁烷.
(4)若制备实验的“回流”过程中不采用“调节为小火”,仍采用大火加热回流,则会使产品产率偏低(填“高”或“低”),试说出其中一种原因:大火,副反应多或产物逸出较多.
(5)若最终得到13.7g纯净的正溴丁烷,则该实验的产率是50%.
 正溴丁烷(CH3CH2CH2CH2Br)是一种重要的有机合成工业原料.在实验中可利用下图装置(加热或夹持装置省略)制备正溴丁烷.制备时的化学反应方程式及有关数据如下:
正溴丁烷(CH3CH2CH2CH2Br)是一种重要的有机合成工业原料.在实验中可利用下图装置(加热或夹持装置省略)制备正溴丁烷.制备时的化学反应方程式及有关数据如下:NaBr+H2SO4═HBr+NaHSO4
C4H9OH+HBr$\stackrel{浓硫酸}{→}$C4H9Br+H2O
| 物质 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 水中溶解性 |
| 正丁醇 | 74 | 0.80 | 117.3 | 微溶 |
| 正溴丁烷 | 137 | 1.27 | 101.6 | 难溶 |
| 溴化氢 | 81 | --- | --- | 极易溶解 |
请回答下列问题:
(1)仪器A的名称是圆底烧瓶,仪器B的作用是冷却、回流;操作中加入沸石的作用是防止暴沸.
(2)装置C中盛装的液体是NaOH溶液,装置C中倒立的漏斗作用是防止倒吸.
(3)制备的粗产物正溴丁烷中往往含有水分、正丁醇等杂质,加入干燥剂出去水分后,再由下列操作中的d制备纯净的正溴丁烷.

(4)若制备实验的“回流”过程中不采用“调节为小火”,仍采用大火加热回流,则会使产品产率偏低(填“高”或“低”),试说出其中一种原因:大火,副反应多或产物逸出较多.
(5)若最终得到13.7g纯净的正溴丁烷,则该实验的产率是50%.
16.化学不仅在书本里,还在生活中.比如厨房里常用小苏打或苏打粉去除鱼腥味,而残留的小苏打或苏打粉异味则应用下列哪种物品去除( )
| A. | 陈醋 | B. | 食盐 | C. | 味精 | D. | 花生油 |
1.下面是两种常见的化学电源示意图,有关说法不正确的是( )
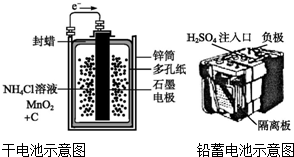

| A. | 上述电池分别属于一次电池、二次电池 | |
| B. | 干电池在长时间使用后,锌筒被破坏 | |
| C. | 铅蓄电池工作过程中,每通过2 mol电子,负极质量减轻207 g | |
| D. | 铅蓄电池负极材料为Pb |
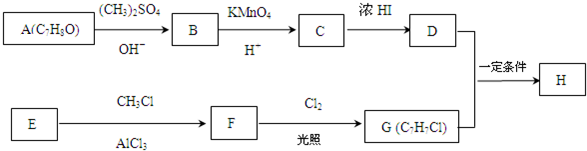
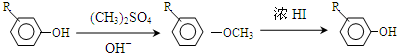
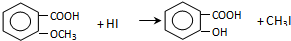 .
.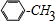 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$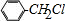 +HCl,反应类型为取代反应.
+HCl,反应类型为取代反应.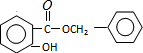 .
. (或
(或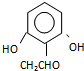 .
.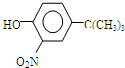
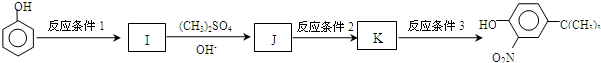
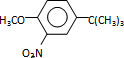 ,反应条件3所用的试剂为浓HI.
,反应条件3所用的试剂为浓HI.