题目内容
15.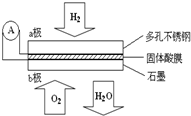 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法不正确的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法不正确的是( )| A. | 电子通过外电路从a极流向b极 | |
| B. | b极上的电极反应式为:O2+4H++4e-═2H2O | |
| C. | 每转移0.1mol电子,消耗1.12L的H2 | |
| D. | H+由a极通过固体酸电解质传递到b极 |
分析 根据电池总反应:2H2+O2=2H2O可知:通入氢气的一极为电池的负极,发生氧化反应,反应为H2-2e-═2H+,通入氧气的一极为电池的正极,发生还原反应,反应为O2+4e-+4H+=2H2O;电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,电解质溶液中阳离子向正极移动,即H+由a极通过固体酸电解质传递到b极;每转移0.1mol电子,消耗0.05mol的H2,以此解答该题.
解答 解:A.电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,故A正确;
B.该电池为酸性电池,所以正极电极反应为O2+4e-+4H+=2H2O,故B正确;
C.每转移0.1mol电子,消耗0.05mol的H2,标准状况下的H2 1.12 L,故C错误;
D.原电池中,阳离子向正极移动,所以H+由a极通过固体酸电解质传递到b极,故D正确.
故选C.
点评 该题是高考中的常见题型,侧重考查学生灵活运用原电池原理解决实际问题的能力.学习中要明确原电池电子以及离子的定向移动问题,要能正确判断原电池的正负极,以及电极反应式的书写等问题,难度不大.

练习册系列答案
相关题目
10.下列说法正确的是( )
| A. | 自然界中所有金属都以化合态形式存在 | |
| B. | 化学史上,金、银、铜发现较早,钾、钠、铝发现较迟是因为前者自然界含量高,后者含量低 | |
| C. | 废旧金属处理的最好办法是深埋 | |
| D. | 冶炼金属的一般步骤是:浮选富集→冶炼→精炼 |
7.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 物质的量浓度为1mol/L100mlHCl溶液中含0.1molHCl分子 |
13.对于某些离子的检验及结论一定正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入稀盐酸溶液没有产生白色沉淀,再加入氯化钡溶液有白色沉淀产生,一定有SO42- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |