题目内容
4.电解1mol熔融的NaCl,能产生标准状况下22.4L氯气,23.0g金属钠错误(判断)分析 电解熔融NaCl时电池反应式为2NaCl$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑,根据转移电子守恒计算生成钠的质量.
解答 解:n(Cl2)=$\frac{22.4L}{22.4L/mol}$=1.0mol,电解熔融NaCl时电池反应式为2NaCl$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑,根据转移电子守恒得m(Na)=$\frac{1.0mol×2}{1}$×23g/mol=46.0g,所以该说法错误,
故答案为:错误.
点评 本题以电解原理为载体考查方程式的计算,为高频考点,明确电解反应原理及各个物理量之间的关系式是解本题关键,也可以利用方程式计算,题目难度不大.

练习册系列答案
相关题目
14.下列物质中,属于天然高分子化合物的是( )
| A. | 油脂 | B. | 葡萄糖 | C. | 蛋白质 | D. | 聚氯乙烯 |
15.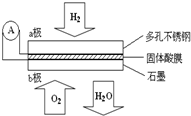 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法不正确的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法不正确的是( )
 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法不正确的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法不正确的是( )| A. | 电子通过外电路从a极流向b极 | |
| B. | b极上的电极反应式为:O2+4H++4e-═2H2O | |
| C. | 每转移0.1mol电子,消耗1.12L的H2 | |
| D. | H+由a极通过固体酸电解质传递到b极 |
12.下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是( )
| 编号 | 化学反应 | 离子方程式 | 评价 |
| ① | 碳酸钙与醋酸反应 | CO32-+2CH3COOH=CO2↑+H2O+2CH3COO- | 错误,碳酸钙是弱电解质,不应写成离子形式 |
| ② | 氢氧化钠溶液中通入CO2 | OH-+CO2=HCO3- | 错误,通往过量CO2应生成CO32- |
| ③ | NaHCO3的水解 | HCO3-+H2O?H2CO3+OH- | 正确 |
| ④ | 等物质的量的FeBr2和Cl2反应 | 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | 正确 |
| A. | ①③ | B. | ③④ | C. | ②③ | D. | ①④ |
9.下列固体,只用水就能区别的是 ( )
| A. | NaCl、NaOH、NH4NO3、CaCO3 | B. | FeCl3、CuSO4、Mg(OH)2、NaCl | ||
| C. | BaSO4、AgCl、KOH、NH4Cl | D. | NH4HCO3、MgCl2、BaCl2、Ba(NO3)2 |
4.有A、B、C、D四种金属,投入水中只有D反应放出氢气,将A投入C的盐溶液中可置换出金属C,B的最高价氧化物的水化物碱性比A的最高价氧化物的水化物碱性强,则四种金属的金属性强弱顺序正确的是( )
| A. | A>B>C>D | B. | D>B>A>C | C. | B>A>C>D | D. | C>A>B>D |
1.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑;
(2)硫酸铜溶液可以加快氢气生成速率的原因是通过一系列反应构成Cu/Zn原电池,该原电池的电极反应式,负极:Zn-2e-=Zn2+;
正极:2H++2e-=H2↑.
(3)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的比表面积等(答两种).
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如表一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应容器中,收集产生的气体,记录获得相同体积的气体所需时间.
①.请完成此实验设计,其中:V1=30mL,V6=10mL,V9=17.5mL;
②.该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入的CuSO4溶液超过一定量时,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑;
(2)硫酸铜溶液可以加快氢气生成速率的原因是通过一系列反应构成Cu/Zn原电池,该原电池的电极反应式,负极:Zn-2e-=Zn2+;
正极:2H++2e-=H2↑.
(3)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的比表面积等(答两种).
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如表一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应容器中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL-1 | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL-1 | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL-1 | V7 | V8 | V9 | V10 | 10 | 0 |
②.该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入的CuSO4溶液超过一定量时,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
2.下列与有机物结构、性质相关的叙述错误的是( )
| A. | 乙酸分子中含有羧基,可与Na2CO3溶液反应生成CO2 | |
| B. | 淀粉和纤维素都属于高分子化合物 | |
| C. | 苯不能使酸性高锰酸钾褪色 | |
| D. | 苯分子中不存在碳碳双键所以不能发生加成反应 |