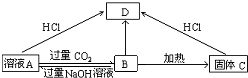
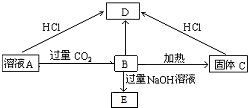
题目内容
13.对于某些离子的检验及结论一定正确的是( )| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入稀盐酸溶液没有产生白色沉淀,再加入氯化钡溶液有白色沉淀产生,一定有SO42- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
分析 A.生成的气体可能为二氧化硫或二氧化碳,原溶液中可能含有亚硫酸根离子、碳酸氢根等离子,不一定含有碳酸根离子;
B.生成的沉淀可能为氯化银,原溶液中可能含有银离子,不一定含有硫酸根离子;
C.加入稀盐酸排除了干扰离子,再加入氯化钡生成的白色沉淀只能为硫酸钡;
D.生成的沉淀可能为碳酸钙,原溶液中可能含有钙离子.
解答 解:A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,该气体可能为二氧化硫,原溶液中可能含有亚硫酸根离子、碳酸氢根离子,不一定有CO32-,故A错误;
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,该沉淀可能为AgCl,原溶液中可能含有银离子,不一定有SO42-,故B错误;
C.加入稀盐酸溶液没有产生白色沉淀,排除了干扰离子,然后再加入氯化钡溶液有白色沉淀产生,该沉淀为硫酸钡,则原溶液中一定有SO42-,故C正确;
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,该沉淀可能为CaCO3,溶液中可能含有Ca2+,不一定有Ba2+,故D错误;
故选C.
点评 本题考查了化学实验方案的评价,题目难度不大,明确常见离子的性质为解答关键,注意检验离子存在时,必须排除干扰离子,确保检验方案的严密性,试题有利于培养学生的分析能力及化学实验能力.

练习册系列答案
相关题目
15.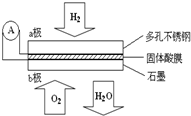 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法不正确的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法不正确的是( )
 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法不正确的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法不正确的是( )| A. | 电子通过外电路从a极流向b极 | |
| B. | b极上的电极反应式为:O2+4H++4e-═2H2O | |
| C. | 每转移0.1mol电子,消耗1.12L的H2 | |
| D. | H+由a极通过固体酸电解质传递到b极 |
4.有A、B、C、D四种金属,投入水中只有D反应放出氢气,将A投入C的盐溶液中可置换出金属C,B的最高价氧化物的水化物碱性比A的最高价氧化物的水化物碱性强,则四种金属的金属性强弱顺序正确的是( )
| A. | A>B>C>D | B. | D>B>A>C | C. | B>A>C>D | D. | C>A>B>D |
1.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑;
(2)硫酸铜溶液可以加快氢气生成速率的原因是通过一系列反应构成Cu/Zn原电池,该原电池的电极反应式,负极:Zn-2e-=Zn2+;
正极:2H++2e-=H2↑.
(3)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的比表面积等(答两种).
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如表一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应容器中,收集产生的气体,记录获得相同体积的气体所需时间.
①.请完成此实验设计,其中:V1=30mL,V6=10mL,V9=17.5mL;
②.该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入的CuSO4溶液超过一定量时,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑;
(2)硫酸铜溶液可以加快氢气生成速率的原因是通过一系列反应构成Cu/Zn原电池,该原电池的电极反应式,负极:Zn-2e-=Zn2+;
正极:2H++2e-=H2↑.
(3)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的比表面积等(答两种).
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如表一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应容器中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL-1 | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL-1 | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL-1 | V7 | V8 | V9 | V10 | 10 | 0 |
②.该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入的CuSO4溶液超过一定量时,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
8.下列说法正确的是( )
| A. | 水的离子积常数量KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度 | |
| B. | Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 | |
| C. | 常温下,在0.10 mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH4+)/c(NH3•H2O)的值增大 | |
| D. | 室温下,CH3COOH的KW=1.7×10-5,NH3•H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3•H2O中的c(OH-)相等 |
18.能用H++OH-→H2O来表示的化学反应是( )
| A. | 碳酸钙与盐酸溶液反应 | B. | 澄清石灰水和HNO3溶液反应 | ||
| C. | KOH溶液和醋酸溶液反应 | D. | Ba(OH)2和H2SO4溶液反应 |
5.下列各组离子能大量共存的是( )
| A. | “84”消毒液的水溶液中:Fe2+、Cl-、H+、Na+ | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、S2- | |
| C. | 无色溶液中:K+、CH3COO-、HCO3-、MnO4- | |
| D. | pH=2的溶液中:NH4+、Na+、Cl-、Cu2+ |
2.下列与有机物结构、性质相关的叙述错误的是( )
| A. | 乙酸分子中含有羧基,可与Na2CO3溶液反应生成CO2 | |
| B. | 淀粉和纤维素都属于高分子化合物 | |
| C. | 苯不能使酸性高锰酸钾褪色 | |
| D. | 苯分子中不存在碳碳双键所以不能发生加成反应 |