题目内容
5.已知反应 A+3B?2C+D 在某段时间内以A的浓度变化表示的化学反应速率为0.5mol/(L•s)则此段时间内以B浓度变化表示的化学反应速率( )| A. | 3 mol/(L•s) | B. | 2mol/(L•s) | C. | 1.5 mol/(L•s) | D. | 0.5mol/(L•s) |
分析 利用速率之比等于化学计量数之比计算v(B).
解答 解:对于反应A+3B=2C+D,以A的浓度变化表示的反应速率为0.5mol/(L•s),速率之比等于化学计量数之比,
所以1:3=0.5mol/(L•s):v(B),解得v(B)=1.5mol/(L•s),
故选C.
点评 本题考查化学反应速率的计算,比较基础,化学反应速率计算常用定义法与化学计量数法,根据情况选择合适的计算方法.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
15.《读卖新闻》3月25日:日本东京电力公司24日宣布,在对福岛第一核电站排水口的海水进行取样化验后,检测出含有微量的放射性物质${\;}_{40}^{95}$Zr.专家表示,这些放射物质来自于核燃料棒.锆被发现了,说明堆心已经彻底熔毁;这不是几年就能解决的问题,最坏的情况发生了.日本前景堪忧!下列关于${\;}_{40}^{95}$Zr的说法正确的是( )
| A. | ${\;}_{40}^{95}$Zr和${\;}_{40}^{92}$Zr两原子的核外电子总数相等 | |
| B. | ${\;}_{40}^{95}$Zr的中子数和电子数之差为55 | |
| C. | ${\;}_{40}^{95}$Zr和${\;}_{40}^{92}$Zr是同种核素 | |
| D. | ${\;}_{40}^{95}$Zr属于非金属元素 |
16.可逆反应2NO2?2NO+O2在恒容密闭容器中进行,下列情况达到平衡状态的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2 ②混合气体的平均相对分子质量不再改变
③NO2、NO、O2的反应速率之比为2:2:1 ④混合气体的颜色不再改变
⑤混合气体的密度不再改变 ⑥混合气体压强不再改变.
①单位时间内生成n mol O2的同时生成2n mol NO2 ②混合气体的平均相对分子质量不再改变
③NO2、NO、O2的反应速率之比为2:2:1 ④混合气体的颜色不再改变
⑤混合气体的密度不再改变 ⑥混合气体压强不再改变.
| A. | ①②④⑥ | B. | ①②③⑤ | C. | ①②⑤⑥ | D. | ①②④⑤ |
13.有4种有机物:① ②
② ③
③ ④CH3-CH═CH2-CN,其中可用于合成
④CH3-CH═CH2-CN,其中可用于合成
结构简式为 的高分子材料的正确组合为( )
的高分子材料的正确组合为( )
 ②
② ③
③ ④CH3-CH═CH2-CN,其中可用于合成
④CH3-CH═CH2-CN,其中可用于合成结构简式为
 的高分子材料的正确组合为( )
的高分子材料的正确组合为( )| A. | ②③④ | B. | ①②③ | C. | ①③④ | D. | ①②④ |
20.X、Y、Z、W、M五种短周期元素,X、Y同周期,X、Z同主族,Y形成化合物种类最多,X2-、W3+具有相同的电子层结构,M为短周期主族元素中原子半径最大的元素.下列说法正确的是( )
| A. | 原子半径大小顺序为M>W>X>Z>Y | |
| B. | W元素形成的可溶性盐溶液一定显碱性 | |
| C. | M、X只能形成离子化合物,且形成的离子化合物中只含离子键 | |
| D. | W的氧化物与Z、M的最高价氧化物的水化物均能反应 |
14.用下列实验装置进行的实验中,不能达到相应实验目的是( )


| A. | 装置甲:测定一定时间内生成H2的速率 | |
| B. | 装置乙:萃取碘水中的碘 | |
| C. | 装置丙:海水蒸馏得淡水 | |
| D. | 装置丁:测定中和热 |
15.某有机物的结构简式为: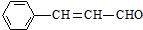 ,则关于该有机物的说法正确的是( )
,则关于该有机物的说法正确的是( )
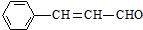 ,则关于该有机物的说法正确的是( )
,则关于该有机物的说法正确的是( )| A. | 1 mol该有机物发生银镜反应能生成 1 mol Ag | |
| B. | 1 mol该有机物最多能够与4 mol H2 发生加成反应 | |
| C. | 它与 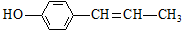 互为同分异构体 互为同分异构体 | |
| D. | 该有机物能使高锰酸钾溶液褪色 |
