题目内容
20.量取20.00mL0.03mol/LX溶液于锥形瓶中,用滴定管逐滴滴入0.03mol/L的Y溶液,溶液的pH变化曲线如图所示,下列说法正确的是( )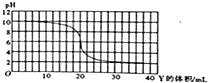
| A. | X和Y可能是KOH和CH3COOH | |
| B. | X和Y可能是NH3•H2O和HCl | |
| C. | X和Y恰好中和时,溶液呈中性 | |
| D. | X和Y恰好完全反应时的溶液中由水电离出的c(H+)=1×10-8mol/L |
分析 A.0.03mol/LX溶液的pH=10,所以X不可能是强碱;
B.X、Y等物质的量恰好反应时,溶液显酸性,则形成的盐是强酸弱碱盐;
C.X、Y等物质的量恰好反应时,溶液显酸性;
D.X、Y等物质的量恰好反应时,溶液显酸性,则形成的盐是强酸弱碱盐,强酸弱碱盐促进水的电离.
解答 解:A.由图可知,0.03mol/LX溶液的pH=10,X在溶液中部分电离,所以X不可能是强碱,即不能是KOH,故A错误;
B.当滴加Y的体积为30mL时,X、Y等物质的量恰好反应时,溶液的pH=6,溶液显酸性,则形成的盐是强酸弱碱盐,所以X和Y可能是NH3•H2O和HCl,故B正确;
C.由B项分析可知,X、Y等物质的量恰好反应时,溶液显酸性,故C错误;
D.X、Y等物质的量恰好反应时,溶液显酸性,则形成的盐是强酸弱碱盐,强酸弱碱盐促进水的电离,溶液的pH=6,所以溶液中由水电离出的c(H+)=1×10-6mol/L,故D错误.
故选B.
点评 本题考查了酸碱中和滴定图象、弱电解质的电离,题目难度不大,注意把握弱电解质的电离特点,侧重于考查学生的分析能力和对基础知识的综合应用能力.

练习册系列答案
相关题目
10.X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是( )
| A. | 若原子半径X>Y,则气态氢化物稳定性:HmX<HnY | |
| B. | X、Y一定不是同周期元素 | |
| C. | 由mXa-与nYb-得m+a=n-b | |
| D. | Xa-的还原性一定强于Yb- |
11.有机物 在不同条件下至少可能发生7种不同类型的有机反应,其中由于分子结构中含-OH而发生的反应有( )
在不同条件下至少可能发生7种不同类型的有机反应,其中由于分子结构中含-OH而发生的反应有( )
①加成反应 ②取代反应 ③消去反应 ④氧化反应 ⑤酯化反应 ⑥加聚反应 ⑦缩聚反应.
 在不同条件下至少可能发生7种不同类型的有机反应,其中由于分子结构中含-OH而发生的反应有( )
在不同条件下至少可能发生7种不同类型的有机反应,其中由于分子结构中含-OH而发生的反应有( )①加成反应 ②取代反应 ③消去反应 ④氧化反应 ⑤酯化反应 ⑥加聚反应 ⑦缩聚反应.
| A. | ①③④ | B. | ②③④⑤ | C. | ④⑤⑥⑦ | D. | ②③④⑤⑦ |
8.下列说法中正确的是( )
| A. | 原子晶体中只含有共价键,离子晶体中只含有离子键 | |
| B. | 原子晶体的熔点一定比金属晶体的高 | |
| C. | 分子晶体熔化时,不破坏共价键;原子晶体熔化时,破坏共价键 | |
| D. | 任何晶体中,若含有阳离子就一定含有阴离子 |
12.下列叙述正确的是( )
| A. | 亚磷酸H3PO3只有Na2HPO3、NaH2PO3两种钠盐,所以亚磷酸没有正盐 | |
| B. | 同周期非金属元素的氧化物对应水化物的酸性从左到右依次增强 | |
| C. | 配位键也有方向性和饱和性 | |
| D. | H3PO4和H2CO3分子中非羟基氧的个数均为1,他们的酸性相近,均为中强酸 |
9.关于离子键、共价键等化学键的下列叙述中正确的( )
| A. | 在单质中一定不存在离子键 | |
| B. | 非极性键只存在于双原子的单质分子(如Cl2)中 | |
| C. | 在离子化合物里,只存在离子键,没有共价键 | |
| D. | 化学键断裂一定伴随着化学变化 |
10.下列混合溶液中,各离子浓度的大小顺序正确的是( )
| A. | 10 mL 0.1 mol•L-1氨水与10 mL 0.1 mol•L-1盐酸混合,c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL 0.1 mol•L-1NH4Cl溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL 0.1 mol•L-1CH3COOH溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL 0.5 mol•L-1CH3COONa溶液与6 mL 1 mol•L-1盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
 已知甲酸(HCOOH)是羧酸中组成最简单的酸,它具有羧酸的性质,在实验室里常用甲酸在浓硫酸的作用下制取少量一氧化碳,现用甲酸与甲醇反应制取甲酸甲酯来验证甲酸具有能发生酯化反应的性质,装置如图所示.
已知甲酸(HCOOH)是羧酸中组成最简单的酸,它具有羧酸的性质,在实验室里常用甲酸在浓硫酸的作用下制取少量一氧化碳,现用甲酸与甲醇反应制取甲酸甲酯来验证甲酸具有能发生酯化反应的性质,装置如图所示.