题目内容
20.由Zn-Cu-硫酸溶液组成的原电池,工作一段时间后,锌片的质量减少了6.5g.回答下列问题:(1)上述原电池的正极是:Cu,负极的电极反应式:Zn-2e-═Zn2+.
(2)若将电解质溶液改为硫酸铜溶液,负极是:Zn,正极的电极反应式:Cu2++2e-═Cu.当电池输出相同的电量时,电池两极的质量差为12.9g.
分析 (1)活泼性强的金属作负极,活泼性弱的作正极,正极上溶液中的阳离子得电子;
(2)若将电解质溶液改为硫酸铜溶液,仍是活泼性强的金属Zn作负极;根据转移电子相等计算生成氢气的体积,根据转移电子相同计算阴极上生成铜的质量,两个电极的差为减少的锌的质量与析出铜质量的和.
解答 解:(1)活泼性强的金属Zn作负极,活泼性弱的Cu作正极,正极上溶液中的氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑,负极上是金属铜失电子的氧化反应,电极反应式为:Zn-2e-=Zn2+;故答案为:Cu;Zn-2e-=Zn2+;
(2)若将电解质溶液改为硫酸铜溶液,仍是活泼性强的金属Zn作负极,Zn失去电子生成锌离子,其电极反应为:Zn-2e-=Zn2+;锌片的质量减少了6.5g,转移电子是0.1mol,正极上铜离子得电子生成Cu,电极反应式为:Cu2++2e-═Cu;电解硫酸铜溶液时,根据转移电子相等,得析出铜的质量是6.4g,两个电极的差为减少的锌的质量与析出铜质量的和,所以两个电极的质量差=6.5g+6.4g=12.9g;
故答案为:Zn;Cu2++2e-═Cu;12.9g.
点评 本题考查原电池的工作原理,根据原电池电极上得失电子来判断正负极,侧重于基础知识的考查,题目难度不大,注意两极电极反应转移的电子数目相等.

练习册系列答案
相关题目
6.碳酸锂(相对分子质量74)广泛应用于化工、冶金、陶瓷、医药、制冷、焊接、锂合金等行业.制备流程如下:

已知:碳酸锂的溶解度为(g/L)
(1)锂辉石(Li2Al2Si4Ox)可以用氧化物的形式表示其组成,形式为Li2O•Al2O3•4SiO2
(2)硫酸化焙烧工业反应温度控制在250~300℃,主要原因是防止浓硫酸蒸发;同时,硫酸用量为理论耗酸量的115%左右,硫酸如果加入过多则C(填入选项代号).
A.增加酸消耗量 B.增加后续杂质的处理量 C.增加后续中和酸的负担
(3)水浸时,需要在搅拌下加入石灰石粉末的主要作用是中和过量的浓硫酸
(4)“沉锂”的化学方程式为Li2SO4+Na2CO3=Li2CO3↓+Na2SO4
(5)“沉锂”需要在95℃以上进行,主要原因是Li2CO3的溶解度小,得到的Li2CO3多.

已知:碳酸锂的溶解度为(g/L)
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
(2)硫酸化焙烧工业反应温度控制在250~300℃,主要原因是防止浓硫酸蒸发;同时,硫酸用量为理论耗酸量的115%左右,硫酸如果加入过多则C(填入选项代号).
A.增加酸消耗量 B.增加后续杂质的处理量 C.增加后续中和酸的负担
(3)水浸时,需要在搅拌下加入石灰石粉末的主要作用是中和过量的浓硫酸
(4)“沉锂”的化学方程式为Li2SO4+Na2CO3=Li2CO3↓+Na2SO4
(5)“沉锂”需要在95℃以上进行,主要原因是Li2CO3的溶解度小,得到的Li2CO3多.
11.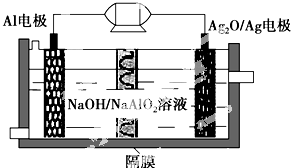 Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示.该电池工作时总反应式为2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O,则下列说法错误的是( )
Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示.该电池工作时总反应式为2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O,则下列说法错误的是( )
 Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示.该电池工作时总反应式为2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O,则下列说法错误的是( )
Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示.该电池工作时总反应式为2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O,则下列说法错误的是( )| A. | 工作时正极发生还原反应 | |
| B. | 当电极上生成1.08 g Ag时,电路中转移的电子为0.01 mol | |
| C. | Al电极的反应式为Al-3e-+4OH-=AlO2-+2H2O | |
| D. | 工作时电解液中的Na+透过隔膜移向Al电极放电充电 |
8.除去下列物质中的杂质(括号中的物质为杂质),请填写下列空白
(注:加入的试剂请填写化学式):
 15.(18分)
15.(18分)
Ⅰ.下列物质中,不可以通过乙烯加成反应得到的是B(填序号).
A.CH3CH3B.CH3CHCl2
C.CH3CH2OHD.CH3CH2Br
Ⅱ.已知 2CH3CHO+O2 $→_{△}^{催化剂}$ 2CH3COOH.若以乙烯为主要原料合成乙酸,其合成路线如下图所示.
反应②的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为 ,反应类型是加聚反应.
,反应类型是加聚反应.
Ⅲ.某同学欲用乙醇和浓硫酸共热得乙烯,探究过程中发现因温度过高,乙烯气体中可能含有少量的二氧化硫,于是设计下列实验对产物进行验证.
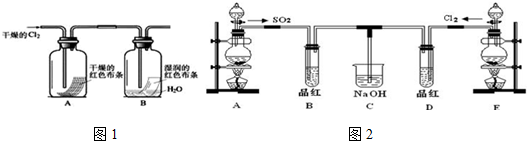
(1)A、B、C、D装置可盛放的试剂是:(将下列需要的试剂序号填入空格内).
A④;B①;C④;D②;
①NaOH溶液 ②溴的四氯化碳溶液 ③浓硫酸 ④品红溶液
(2)确定含有乙烯的现象为溴水褪色,反应的化学方程式:CH2=CH2+Br2→CH2Br-CH2Br
(注:加入的试剂请填写化学式):
| 物质 | 加入试剂 | 离子方程式 |
| NH4Cl(AlCl3)溶液 | ||
| NaHCO3(Na2CO3)溶液 | ||
| Fe 粉(Al粉) | ||
| FeCl3(FeCl2)溶液 |
 15.(18分)
15.(18分)Ⅰ.下列物质中,不可以通过乙烯加成反应得到的是B(填序号).
A.CH3CH3B.CH3CHCl2
C.CH3CH2OHD.CH3CH2Br
Ⅱ.已知 2CH3CHO+O2 $→_{△}^{催化剂}$ 2CH3COOH.若以乙烯为主要原料合成乙酸,其合成路线如下图所示.
反应②的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为
 ,反应类型是加聚反应.
,反应类型是加聚反应.Ⅲ.某同学欲用乙醇和浓硫酸共热得乙烯,探究过程中发现因温度过高,乙烯气体中可能含有少量的二氧化硫,于是设计下列实验对产物进行验证.

(1)A、B、C、D装置可盛放的试剂是:(将下列需要的试剂序号填入空格内).
A④;B①;C④;D②;
①NaOH溶液 ②溴的四氯化碳溶液 ③浓硫酸 ④品红溶液
(2)确定含有乙烯的现象为溴水褪色,反应的化学方程式:CH2=CH2+Br2→CH2Br-CH2Br
15.下列叙述中,正确的是( )
| A. | 钢铁腐蚀的负极反应为:Fe-3e-=Fe3+ | |
| B. | Mg-Al及NaOH溶液构成的原电池中负极材料为Mg | |
| C. | 无隔膜电解饱和NaCl溶液所得产物之一是“84”消毒液中的有效成分NaClO | |
| D. | H2-O2燃料电池中电解液为H2SO4,则正极反应式为:O2+4e-=2O2- |
10.下列实验操作现象和结论均正确的是( )
| 操作及现象 | ||
| A | 某溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 溶液中一定含有CO32- |
| B | 将砂纸打磨过的铝箔置于酒精灯外焰上灼烧,熔化的铝以小液滴的形式滴落下来 | Al的熔点低,加热时Al熔化 |
| C | 用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色 | 溶液中有Na+,无Κ+ |
| D | 向某溶液中先加几滴KSCN溶液,无明显现象,再滴加氯水,溶液变红 | 溶液中一定含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
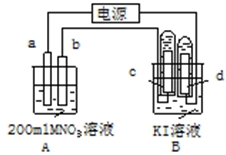 如图装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡.试回答
如图装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡.试回答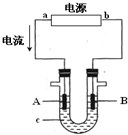 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题: