题目内容
实验室用硫酸厂烧渣制备聚铁(碱式硫酸铁的聚合物).为测量聚铁样品中铁元素的质量分数,进行下列实验(假设杂质中不含铁元素和硫元素):称取2.700g样品,将样品溶于足量的盐酸后,滴加过量的BaCl2:过滤、洗涤、干燥,称量固体的质量为3.495g.若该聚铁的主要成分为[Fe(OH)(SO4)]n,求该聚铁样品中铁元素的质量分数.(写出计算过程,结果保留4位有效数字)
考点:离子方程式的有关计算
专题:计算题
分析:根据n(Fe3+)=n(SO42-)计算.
解答:
解:过滤、洗涤、干燥,称量,得固体质量为3.495g,应为BaSO4沉淀,
n(BaSO4)=
=0.015mol,
则n(Fe3+)=n(SO42-)=0.015mol,
m(Fe)=0.015mol×56g/mol=0.84g,
ω(Fe)=
×100%=31.11%,
答:聚铁样品中铁元素的质量分数为31.11%.
n(BaSO4)=
| 3.495g |
| 233g/mol |
则n(Fe3+)=n(SO42-)=0.015mol,
m(Fe)=0.015mol×56g/mol=0.84g,
ω(Fe)=
| 0.84g |
| 2.7g |
答:聚铁样品中铁元素的质量分数为31.11%.
点评:本题考查元素质量分数的求法,学生只要抓住铁离子与硫酸根离子的物质的量之比为1:1,就可以迅速解题了,比较容易.

练习册系列答案
相关题目
设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、78g Na2O2与足量CO2充分反应时电子转移数为2NA |
| B、NA个氯气分子的体积为22.4L |
| C、4℃、101kPa时,54mL H2O中含有的分子数为3NA |
| D、1mol/L Na2SO4溶液中离子总数为3NA |
下列离子方程式中,正确的是( )
| A、向AlCl3溶液中滴加过量的氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、CaCO3与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
| C、小苏打治疗胃酸过多:CO32-+2H+=CO2↑+2H2O |
| D、Cu片与浓硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
下列说法不正确的是( )
| A、生铁、不锈钢和黄铜都属于合金 |
| B、水泥、玻璃、陶瓷均属于无机非金属材料 |
| C、氧化钙、氧化镁、氧化铝都属于碱性氧化物 |
| D、溶液、胶体、浊液都属于分散系 |
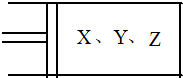 如图所示,将6mol X和3mol Y混合气体置于体积可变的等压容器中,在一定温度下发生如下反应:2X(g)+Y(g)?2Z(g).反应达到平衡状态A时,测得气体总物质的量为6.6mol.若X、Y、Z的起始物质的量分别用a.b.c表示,回答下列问题:
如图所示,将6mol X和3mol Y混合气体置于体积可变的等压容器中,在一定温度下发生如下反应:2X(g)+Y(g)?2Z(g).反应达到平衡状态A时,测得气体总物质的量为6.6mol.若X、Y、Z的起始物质的量分别用a.b.c表示,回答下列问题: 硼酸钛[(TiO)2(B2O5)?4H2O]是一种高效节能润滑油添加剂,可用硫酸氧钛和硼砂的溶液为原料湿法合成.
硼酸钛[(TiO)2(B2O5)?4H2O]是一种高效节能润滑油添加剂,可用硫酸氧钛和硼砂的溶液为原料湿法合成.