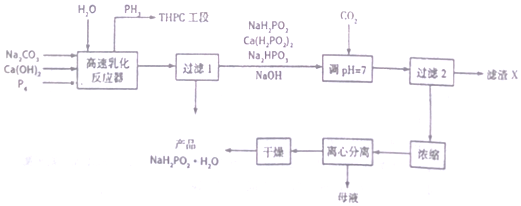
题目内容
14.NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 常温下7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA | |
| B. | 1mol/L的氯化铁溶液中,若Cl-的数目为3NA,则Fe3+的数目为NA | |
| C. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol,当放出热量9.2 kJ时,转移电子0.6 NA | |
| D. | 标准状况下,11.2L三氯甲烷中含有含极性共价键数目为1.5NA |
分析 A.CaO2晶体中阴离子为过氧根离子;
B.Fe3+水解,导致Fe3+的浓度小于氯化铁的浓度;
C.反应3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol转移6mol电子;
D.气体摩尔体积使用对象为气体.
解答 解:A.常温下7.2 g CaO2晶体物质的量为$\frac{7.2g}{72g/mol}$=0.1mol,含有0.1mol过氧根离子和0.1mol钙离子,阴离子和阳离子总数为0.2 NA,故A错误;
B.因氯化铁是强酸弱碱盐,Fe3+易水解,导致Fe3+的浓度小于Cl-的三分之一,故B错误;
C.反应3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol转移6mol电子,放出热量9.2 kJ时,转移电子0.6 NA,故C正确;
D.标况下三氯甲烷为液体,不能使用气体摩尔体积,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的运用、物质的状态和物质的结构是关键,难度不大,注意气体摩尔体积使用条件和对象,注意盐类水解的性质及应用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.对于可逆反应N2(g)+3H2(g)?2NH3(g)下列各项表示的是在4种不同情况下的反应速率,其中反应速率最快的是( )
| A. | V(N2)=0.01mol/(L•S) | B. | V(H2)=0.2mol/(L•S) | ||
| C. | V(H2)=0.6mol/(L•min) | D. | V(NH3)=1.2mol/(L•min) |
5.某溶液经分析,其中只含有Na+、K+、Ca2+、Cl-、NO3-,已知其中Na+、K+、Ca2+、NO3-的浓度均为0.1mol•L-1,则Cl-的物质的量浓度为( )
| A. | 0.1mol•L-1 | B. | 0.3mol•L-1 | C. | 0.2mol•L-1 | D. | 0.4mol•L-1 |
2.下列实验报告记录的实验现象正确的是( )
| 实验 | 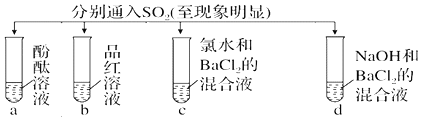 | ||||
| 现象 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 无色 | 无色 | 溶液变无色,白色沉淀 | 白色沉淀 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
| A. | A | B. | B | C. | C | D. | D |
19.用NA表示阿伏伽德罗常数的值,下列叙述中正确的是( )
| A. | 在常温常压下,2.24L NH3与1.8g H2O,所含的质子数均为NA | |
| B. | 在常温常压下,1mol Cl2与足量的NaOH溶液完全反应,转移电子2NA | |
| C. | 在标准状况下,64g SO2 中含有的原子数为3NA | |
| D. | 在标准状况下,11.2L H2O含有的分子数为0.5NA |
6.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,1.12L CCl4含有的共价键数为0.2NA | |
| B. | 常温常压下,2.3g NO2和N2O4的混合物中含有的氧原子数为0.2NA | |
| C. | 过氧化钠与水反应时,生成0.lmol氧气转移的电子数为0.2NA | |
| D. | 常温下,0.1mol•L-1溶液中阴离子总数大于0.1NA |
10.在pH=1的无色透明溶液中,能大量共存的离子组是( )
| A. | K+、MnO4-、Ag+、Cl- | B. | Cu2+、NO3-、Na+、OH- | ||
| C. | Fe2+、NH4+、NO3-、SO42- | D. | Al3+、Na+、Cl-、SO42- |
11.下列反应的离子方程式书写正确的是( )
| A. | 锌片插入硝酸银溶液中:Zn+Ag+═Zn2++Ag | |
| B. | 硫化钠溶液中通入足量二氧化硫:2S2-+5SO2+2H2O═3S↓+4HSO3- | |
| C. | 碳酸氢镁溶液中滴入足量氢氧化钠溶液:Mg2++HCO3-+OH-═Mg CO3↓+H2O | |
| D. | 碳酸氢钙溶液加到醋酸中:HCO3-+H+═CO2↑+H2O |