题目内容
15.相同物质的量浓度的KCl、MgCl2、AlCl3三种溶液,分别与体积相同、物质的量浓度相同的AgNO3溶液恰好完全反应,消耗的这三种溶液的体积比是( )| A. | 2:3:6 | B. | 6:3:2 | C. | 1:2:3 | D. | 3:2:1 |
分析 由题意可知完全沉淀,则Cl-+Ag+═AgCl↓,分别与体积相同、物质的量浓度相同的AgNO3溶液恰好完全反应,设消耗的AgNO3溶液的物质的量都是n,则氯离子的物质的量为nmol,则利用n=cV可计算三种溶液的体积比.
解答 解:由题意可知完全沉淀,则Cl-+Ag+═AgCl↓,分别与体积相同、物质的量浓度相同的AgNO3溶液恰好完全反应,设消耗的AgNO3溶液的物质的量都是n,则氯离子的物质的量为nmol,
设KCl、MgCl2、AlCl3溶液的浓度都是c1,设等物质的量浓度的KCl、MgCl2、AlCl3三种溶液体积分别为x、y、z,完全沉淀时发生反应Cl-+Ag+═AgCl↓,
由方程式可知:
n=c1×x=c1×2×y=c1×3×z,
解得x:y:z=6:3:2,
故选B.
点评 本题考查利用离子反应方程式进行的计算,明确完全沉淀时氯离子和银离子的关系是解答本题的关键,注意解答中未知的量可以利用假设来分析解答即可,题目难度不大

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
5.运用化学反应原理研究碳、氮、硫等单质及其化合物的反应有重要的意义.
(1)CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:
2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g)△H=QkJ/mol (Q>0)
在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图1所示.
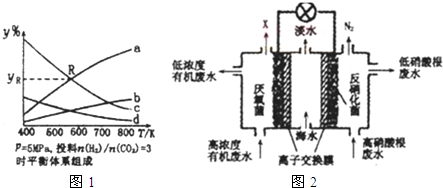
完成下列填空:
①图中曲线a表示的是H2O的体积分数.
②图中曲线a和c的交点R对应物质的体积分数yR=37.5%.
(2)25° C,H2SO3和H2CO3两种酸的电离平衡常数如表.
将足量的NaHSO溶液加人到Na2CO3溶液中,反应的离子方程式为CO32-+HSO3-=HCO3-+SO32-
(3)工业上用可溶性碳酸盐提取锶时,先将SrSO4转化为难溶弱酸盐,再处理.
SrSO4?Sr2+(aq)+SO${\;}_{4}^{2-}$(aq) Ksp=2.5×10-7
SrCO3?Sr2+(aq)+CO${\;}_{3}^{2-}$(aq) Ksp=2.5×10-9
则SrSO4转化为SrCO3反应的平衡常数值为100
(4)图2是一种三室微生物燃料电池污水净化系统原理示意图,同时处理有机废水和硝酸盐废水,并获得淡水,图中有机废水中有机物可用C6H10O5表示.
①产生N2的电极为电池的正极(填“正”或“负”).
②生成X(气体)的电极上发生的电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+.
(1)CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:
2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g)△H=QkJ/mol (Q>0)
在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图1所示.

完成下列填空:
①图中曲线a表示的是H2O的体积分数.
②图中曲线a和c的交点R对应物质的体积分数yR=37.5%.
(2)25° C,H2SO3和H2CO3两种酸的电离平衡常数如表.
| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.4×10-7 | 4.7×10-11 |
(3)工业上用可溶性碳酸盐提取锶时,先将SrSO4转化为难溶弱酸盐,再处理.
SrSO4?Sr2+(aq)+SO${\;}_{4}^{2-}$(aq) Ksp=2.5×10-7
SrCO3?Sr2+(aq)+CO${\;}_{3}^{2-}$(aq) Ksp=2.5×10-9
则SrSO4转化为SrCO3反应的平衡常数值为100
(4)图2是一种三室微生物燃料电池污水净化系统原理示意图,同时处理有机废水和硝酸盐废水,并获得淡水,图中有机废水中有机物可用C6H10O5表示.
①产生N2的电极为电池的正极(填“正”或“负”).
②生成X(气体)的电极上发生的电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+.
3.盛装下列溶液的试剂瓶使用橡胶塞的是( )
| A. | 硫酸 | B. | NaOH溶液 | C. | 盐酸 | D. | NaCl溶液 |
10.下列说法正确的是( )
| A. | 失电子越多,还原性就越强,得电子越多,氧化性越强 | |
| B. | 金属单质在化学反应中一定作为还原剂,非金属单质在反应中可以作氧化剂 | |
| C. | 强电解质溶液的导电能力一定强,弱电解质溶液的导电能力一定弱 | |
| D. | 凡是强酸和强碱反应的离子方程式都可以用H++OH-=H2O表示 |
20.下列关于物质结构的说法正确的为( )
| A. | 分子中一定含有共价键 | |
| B. | 区分离子化合物和共价化合物的方法是看其水溶液是否能导电 | |
| C. | 离子化合物只含离子键 | |
| D. | 离子化合物在熔融状态能够电离出自由移动的离子,而共价化合物不能 |
7.下列说法中,不正确的是( )
| A. | 将煤干馏制得煤焦油和焦炭 | |
| B. | 从海水中可以得到氯化镁,再加热分解可制金属镁 | |
| C. | 将石油裂解制得乙烯等化工原料 | |
| D. | 煤的气化主要反应是C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g) |
4.等质量的下列物质,完全燃烧消耗氧气的质量最大的是( )
| A. | C4H8 | B. | C3H6 | C. | C2H4 | D. | CH4 |
 +2H2O.
+2H2O.