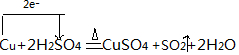题目内容
4.等质量的下列物质,完全燃烧消耗氧气的质量最大的是( )| A. | C4H8 | B. | C3H6 | C. | C2H4 | D. | CH4 |
分析 由烃燃烧中C~O2~CO2,4H~O2~2H2O可知,消耗1molO2需要12gC,而消耗1molO2需要4gH,可知相同质量烃CxHy中氢的质量分数越大,完全燃烧耗氧越多.即$\frac{y}{x}$越大,耗氧量越大,以此来解答.
解答 解:同质量烃CxHy中氢的质量分数越大,完全燃烧耗氧越多.
A.C4H8分子中H原子与C原子个数比为2:1;
B.C3H6中H原子与C原子个数比为2:1;
C.C2H4中H原子与C原子个数比为2:1;
D.CH4分子中H原子与C原子个数比为4:1;
所以相同质量的各烃CH4的燃烧耗氧量最大.
故选D.
点评 本题考查烃的燃烧耗氧量计算,题目难度不大,注意规律的归纳总结及应用,明确相同质量烃CxHy燃烧耗氧量规律为:氢的质量分数越大,完全燃烧耗氧越多.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
14.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 反应N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol 放出热量9.2KJ时,转移电子0.6 NA | |
| B. | 7.2g CaO2晶体中阴离子和阳离子总数为0.3NA | |
| C. | 标准状况下,11.2L苯中含有碳氢键的数目为3NA | |
| D. | 0.1mol H2O2分子中含极性共价键数目为0.3NA |
15.相同物质的量浓度的KCl、MgCl2、AlCl3三种溶液,分别与体积相同、物质的量浓度相同的AgNO3溶液恰好完全反应,消耗的这三种溶液的体积比是( )
| A. | 2:3:6 | B. | 6:3:2 | C. | 1:2:3 | D. | 3:2:1 |
12.能用来区别甲烷和乙烯的是( )
| A. | 水 | B. | 酒精 | ||
| C. | 酸性高锰酸钾溶液 | D. | NaOH溶液 |
19.SO2通入足量Fe(NO3)3稀溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀.针对上述一系列变化过程中,下列说法中不正确的是( )
| A. | 上述过程中,最终被还原的是NO3- | |
| B. | 从上述过程中可以得出结论,氧化性:HNO3>Fe3+>稀H2SO4 | |
| C. | 假设通入的SO2完全反应,则同温同压下,SO2和逸出气体的体积为1:1 | |
| D. | 上述过程中,会产生一种无色的难溶于水的气体 |
13.分枝酸可用于生化研究.其结构简式如图,下列关于分枝酸的叙述正确的是( )
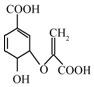

| A. | 分子式为C9H10O6 | |
| B. | 可与乙醇、乙酸反应,且反应类型相同 | |
| C. | 可使溴的四氧化碳溶液,酸性高锰酸钾溶液褪色,且原理相同 | |
| D. | 分子中含有三种官能团 |
14.下列离子方程式书写正确的是( )
| A. | 氯化铝溶液与过量氨水的反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 氯水与碘化钾溶液的反应:Cl2+2I-═2Cl-+I2 | |
| C. | 铁粉与足量稀硫酸的反应:2Fe+3H+═2Fe3++3H2↑ | |
| D. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- |
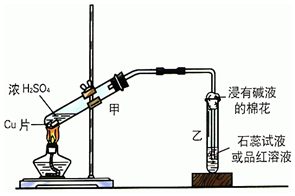 实验室常用如图装置来进行铜跟浓硫酸反应等一系列实验.
实验室常用如图装置来进行铜跟浓硫酸反应等一系列实验.