题目内容
20.下列关于物质结构的说法正确的为( )| A. | 分子中一定含有共价键 | |
| B. | 区分离子化合物和共价化合物的方法是看其水溶液是否能导电 | |
| C. | 离子化合物只含离子键 | |
| D. | 离子化合物在熔融状态能够电离出自由移动的离子,而共价化合物不能 |
分析 A.单原子分子不含共价键;
B.离子化合物、共价化合物且属于电解质,水溶液能导电;
C.离子化合物可能含有共价键;
D.离子化合物在熔融状态下可电离.
解答 解:A.单原子分子不含共价键,如He等,故A错误;
B.离子化合物、共价化合物且属于电解质,水溶液能导电,应用熔融状态下是否导电判断,故B错误;
C.离子化合物可能含有共价键,如NaOH,故C错误;
D.离子化合物在熔融状态下可电离,能导电,而共价化合物不电离,在熔融状态下不导电,故D正确.
故选D.
点评 本题考查离子化合物、共价化合物等知识,为高频考点,侧重于学生的分析能力的考查,注意把握离子化合物、共价化合物性质的区别,难度不大.

练习册系列答案
相关题目
10.铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:
①2Fe2O3(s)+3C(s)?4Fe(s)+3CO2(g)△H=+460.5KJ•mol-1
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5KJ•mol-1
③断裂1mol CO(s)气体中的化学键需要吸收1076KJ的能量
断裂1mol CO2(s)气体中的化学键需要吸收1490KJ的能量
请回答:
(1)断裂1mol C(s)中所有化学键需要吸收的能量为834.5kJ.
(2)T1℃时,向密闭容器中加入一定量的Fe2O3和C,发生反应①,达到平衡后,CO2的浓度为a mol•L-1;其他条件不变,缩小容器容积,再次达到平衡时,CO2的浓度为b mol•L-1,则a=(选填“>”“<”或“=”)b.
(3)起始温度均为T2℃时,向容积为10L的三个恒容密闭容器中,分别加入一定量的Fe2O3和CO发生反应②,测得相关数据如表所示:
①T2℃时,容器1中反应的平衡常数K1=64.
②容器2中,5min达到平衡,则0~5min内以CO2表示该反应的速率v(CO2)=0.048mol/(L•min).
③对于三个容器中的反应,下列说法正确的是D(填选项字母).
A.m>2n
B.容器1和容器2中CO的平衡转化率v1<v2.
C.K1=K3
D.平衡时气体压强:P3>P1
(4)T2℃时,向恒压密闭容器中充入0.5mol Fe2O3和1.0mol CO,发生反应②,CO和CO2的物质的量浓度(c)与时间(t)的关系如图1所示.
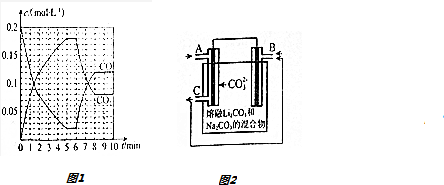
①6min时,改变的外界条件未升温,理由为升温,平衡逆向移动,CO浓度增大,CO2浓度减小.
②10min时,再向容器中加入1 mol Fe2O3、1 mol CO、1 mol Fe、1 mol CO2、起始的反应速率v(正)<(选填“>”“<”或“=”)v(逆).
(5)CO-O2熔融盐燃料电池的装置如图2所示,电池工作时,C口产生的气体一部分通入B口被利用,另一部分被分离出来,若导线中流过2mole-,理论上C口被分离出的气体的物质的量最多为1mol.
①2Fe2O3(s)+3C(s)?4Fe(s)+3CO2(g)△H=+460.5KJ•mol-1
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5KJ•mol-1
③断裂1mol CO(s)气体中的化学键需要吸收1076KJ的能量
断裂1mol CO2(s)气体中的化学键需要吸收1490KJ的能量
请回答:
(1)断裂1mol C(s)中所有化学键需要吸收的能量为834.5kJ.
(2)T1℃时,向密闭容器中加入一定量的Fe2O3和C,发生反应①,达到平衡后,CO2的浓度为a mol•L-1;其他条件不变,缩小容器容积,再次达到平衡时,CO2的浓度为b mol•L-1,则a=(选填“>”“<”或“=”)b.
(3)起始温度均为T2℃时,向容积为10L的三个恒容密闭容器中,分别加入一定量的Fe2O3和CO发生反应②,测得相关数据如表所示:
| 编号 | 容器 | 起始时物质的量 mol | 平衡时物质的量/mol | 平衡常数(K) | |
| Fe2O3 | CO | Fe | |||
| 1 | 恒温 | 0.5 | 1.5 | 0.8 | K1 |
| 2 | 恒温 | 2 | 3 | m | K2 |
| 3 | 绝热 | 1 | 1.5 | n | K3 |
②容器2中,5min达到平衡,则0~5min内以CO2表示该反应的速率v(CO2)=0.048mol/(L•min).
③对于三个容器中的反应,下列说法正确的是D(填选项字母).
A.m>2n
B.容器1和容器2中CO的平衡转化率v1<v2.
C.K1=K3
D.平衡时气体压强:P3>P1
(4)T2℃时,向恒压密闭容器中充入0.5mol Fe2O3和1.0mol CO,发生反应②,CO和CO2的物质的量浓度(c)与时间(t)的关系如图1所示.

①6min时,改变的外界条件未升温,理由为升温,平衡逆向移动,CO浓度增大,CO2浓度减小.
②10min时,再向容器中加入1 mol Fe2O3、1 mol CO、1 mol Fe、1 mol CO2、起始的反应速率v(正)<(选填“>”“<”或“=”)v(逆).
(5)CO-O2熔融盐燃料电池的装置如图2所示,电池工作时,C口产生的气体一部分通入B口被利用,另一部分被分离出来,若导线中流过2mole-,理论上C口被分离出的气体的物质的量最多为1mol.
11.满足分子式为C5H11Cl的有机物共有( )
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
15.相同物质的量浓度的KCl、MgCl2、AlCl3三种溶液,分别与体积相同、物质的量浓度相同的AgNO3溶液恰好完全反应,消耗的这三种溶液的体积比是( )
| A. | 2:3:6 | B. | 6:3:2 | C. | 1:2:3 | D. | 3:2:1 |
12.能用来区别甲烷和乙烯的是( )
| A. | 水 | B. | 酒精 | ||
| C. | 酸性高锰酸钾溶液 | D. | NaOH溶液 |
10.下列反应不属于氧化还原反应的是( )
| A. | 3Fe+4H2O(g) $\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 | |
| B. | 3NO2+H2O═2HNO3+NO | |
| C. | Ca(OH)2+SO2═CaSO3+H2O | |
| D. | Cu+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O |
 如图是一个电解过程示意图.假设使用N2H4-空气燃料电池作为本过程的电源,铜片质量变化128g,则N2H4一空气燃料电池理论上消耗标准状况下的空气(设空气中氧气的体积含量为20%)112L.
如图是一个电解过程示意图.假设使用N2H4-空气燃料电池作为本过程的电源,铜片质量变化128g,则N2H4一空气燃料电池理论上消耗标准状况下的空气(设空气中氧气的体积含量为20%)112L.