题目内容
2.短周期主族元素M、N、R、T的原子半径与族序数关系如图所示,下列推断不正确的是( )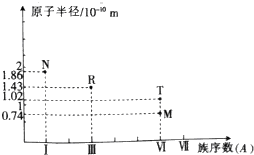
| A. | 常压下,单质R的熔点高于单质M的熔点 | |
| B. | R、T的简单离子都会破坏水的电离平衡 | |
| C. | N2M2与R2M3中所含化学键的类型完全相同 | |
| D. | N、R、T的最高价氧化物对应的水化物之间能相互反应 |
分析 由短周期元素的原子半径和族序数可知M为O元素,Y为S元素,R为Al元素,N为Na元素,结合对应单质、化合物的性质以及元素周期率知识解答该题.
解答 解:由短周期元素的原子半径和族序数可知M为O元素,Y为S元素,R为Al元素,N为Na元素,
A.R为Al,M为S,Al的熔点较高,故A正确;
B.Al、S的简单离子都可发生水解,可促进水的电离,故B正确;
C.Na2O2含有离子键和共价键,Al2O3只含离子键,故C错误;
D.氢氧化铝为两性氢氧化物,可与强碱、强酸反应,故D正确.
故选C.
点评 本题考查位置结构性质的关系及应用,题目难度中等,推断元素是解题的关键,根据原子半径变化规律结合原子序数进行推断,审题中要抓住“短周期主族元素”几个字.

练习册系列答案
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
12. 碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.
碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.
(1)石墨烯是一种由碳原子构成的单层片状结构的新材料,结构如右图所示.则12g石墨烯中含有0.5NA个6元环.
(2)工业上利用甲烷和氧气直接氧化制取甲醇的反应如下:
CH4+$\frac{1}{2}$O2(g)?CH3OH(g)△H=-128.5kJ/mol
副反应有:CH4(g)+$\frac{3}{2}$O2(g)?CO(g)+2H2O(g)△H=a kJ/mol
CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H=b kJ/mol
CH4(g)+O2(g)→HCHO(g)+H2O(g)△H=c kJ/mol
①若要有利于甲醇的生成,除了改变温度外,还可以采取的两种措施是增大压强、选用合适的催化剂;
②甲醇与氧气反应生成HCHO(g)和水蒸汽的热化学方程式为CH3OH(g)+$\frac{1}{2}$O2(g)→HCHO(g)+H2O(g)△H=(c+128.5)KJ•L-1.
(3)苯乙烷(C8H10)生产苯乙烯(C8H8)的反应:C8H10(g)?C8H8(g)+H2(g)△H>0.T1℃下,将0.40mol苯乙烷充入2L密闭容器中反应,不同时间容器内n(C8H10)如下表:
2当反应进行到30min时恰好到达平衡,则n2取值的最小范围是0.22<n<0.26;
②改变温度为T2℃,其他条件不变,测得平衡时容器内气体压强为反应前的1.4倍,则此时苯乙烷的转化率为40%.
(4)用惰性电极电解葡萄糖和硫酸钠混合溶,可以制得葡萄糖酸[CH2OH(CHOH)4COOH]和己六醇[CH2OH(CHOH)4CH2OH].葡萄糖酸在阳极生成,对应的电极反应式CH2OH(CHOH)4CHO+H2O-2e-═CH2OH(CHOH)4COOH+2H+.
 碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.
碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.(1)石墨烯是一种由碳原子构成的单层片状结构的新材料,结构如右图所示.则12g石墨烯中含有0.5NA个6元环.
(2)工业上利用甲烷和氧气直接氧化制取甲醇的反应如下:
CH4+$\frac{1}{2}$O2(g)?CH3OH(g)△H=-128.5kJ/mol
副反应有:CH4(g)+$\frac{3}{2}$O2(g)?CO(g)+2H2O(g)△H=a kJ/mol
CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H=b kJ/mol
CH4(g)+O2(g)→HCHO(g)+H2O(g)△H=c kJ/mol
①若要有利于甲醇的生成,除了改变温度外,还可以采取的两种措施是增大压强、选用合适的催化剂;
②甲醇与氧气反应生成HCHO(g)和水蒸汽的热化学方程式为CH3OH(g)+$\frac{1}{2}$O2(g)→HCHO(g)+H2O(g)△H=(c+128.5)KJ•L-1.
(3)苯乙烷(C8H10)生产苯乙烯(C8H8)的反应:C8H10(g)?C8H8(g)+H2(g)△H>0.T1℃下,将0.40mol苯乙烷充入2L密闭容器中反应,不同时间容器内n(C8H10)如下表:
| 时间/min | 0 | 10 | 20 | 30 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 |
②改变温度为T2℃,其他条件不变,测得平衡时容器内气体压强为反应前的1.4倍,则此时苯乙烷的转化率为40%.
(4)用惰性电极电解葡萄糖和硫酸钠混合溶,可以制得葡萄糖酸[CH2OH(CHOH)4COOH]和己六醇[CH2OH(CHOH)4CH2OH].葡萄糖酸在阳极生成,对应的电极反应式CH2OH(CHOH)4CHO+H2O-2e-═CH2OH(CHOH)4COOH+2H+.
10.常温下,下列各组离子,在所给条件下能够大量共存的是( )
| A. | pH=0的溶液中,Fe3+、Mg2+、Cl-、SO42- | |
| B. | 水电离出的c(H+)=1×10-10的溶液中,K+、HCO3-、Na+、S2- | |
| C. | 使pH试纸显深蓝色的溶液中,Cu2+、Fe3+、NO3-、SO42- | |
| D. | 在AlCl3溶液中:Na+、SO42-、NH4+、NO3- |
7.下列有关碱金属元素铷(Rb)的叙述中,正确的是( )
| A. | 铷与水反应的现象跟钠相似 | |
| B. | 硝酸铷易溶于水 | |
| C. | 在钠、钾、铷三种单质中,铷的熔点最高 | |
| D. | 氢氧化铷是弱碱 |
14.下列有关物质的性质或结构的说法正确的是( )
| A. | OH-中含有9个质子,9个电子 | |
| B. | Na的原子半径比Cl的大,但Na+的半径比Cl-的小 | |
| C. | 与某非金属反应时甲原子失电子数目比乙的多,说明甲的金属性比乙强 | |
| D. | Na2O 和Na2O2中所含的化学键类型完全相同 |
8.如图装置中,将电能转化为化学能的是( )
| A. |  火力发电 | B. |  硅太阳能电池 | ||
| C. |  用手机打电话 | D. |  用食盐水自制消毒液 |

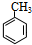 +Br2$\stackrel{光照}{→}$
+Br2$\stackrel{光照}{→}$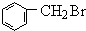 +HBr
+HBr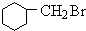 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$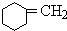 +NaBr+H2O
+NaBr+H2O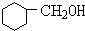 +NaBr.
+NaBr.
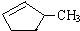 的说法正确的是A.
的说法正确的是A.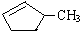 和
和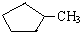
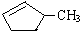 和
和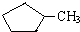 完全燃烧时的耗氧量相同
完全燃烧时的耗氧量相同 可与水以任意比互溶
可与水以任意比互溶