题目内容
15.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )| A. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 标准状况下,2.24L Cl2与H2O反应,转移的电子总数为0.1NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 标准状况下,22.4L甲醇中含有的氧原子数为1.0NA |
分析 A.pH=13的1.0LBa(OH)2溶液中氢氧根离子浓度=$\frac{1{0}^{-14}}{1{0}^{-13}}$=0.1mol/L,计算氢氧根离子数;
B.氯气与水的反应为可逆反应;
C.根据乙烯和丁烯的最简式都是CH2的特点来分析;
D、根据标准状况下甲醇为液态来分析.
解答 解:A.pH=13的1.0LBa(OH)2溶液中氢氧根离子浓度=$\frac{1{0}^{-14}}{1{0}^{-13}}$=0.1mol/L,计算氢氧根离子数=0.1mol/L×1L×NA=0.1NA,故A错误;
B.氯气与水的反应为可逆反应,即0.1mol氯气不能完全反应,转移电子数小于0.1mol,故B错误;
C、乙烯和丁烯的最简式都是CH2,则$n(C{H}_{2})=\frac{21g}{14g/mol}$=1.5mol,所以n(C)=1.5mol,N(C)=1.5NA,故C正确;
D、标准状况下,甲醇为液态,那么甲醇的物质的量就不是1mol,则所含有的氧原子个数也不为NA,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是氧化还原反应电子转移计算,物质结构理解应用,掌握基础是关键,题目较简单.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
5.下列化学用语表示不正确的是( )
| A. | 亚硫酸在溶液中主要的电离方程式:H2SO3?H ++HSO3- | |
| B. | 用铁棒作阳极电解饱和氯化钠溶液的反应:2C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 热的纯碱溶液可以清洗油污的原因:CO32-+H2O?HCO3-+OH- | |
| D. | 钢铁发生电化学腐蚀的负极反应式:Fe一2e-═Fe2+. |
6.下列有关物质的保存方法,不正确的是( )
| A. | 液氯储存在钢瓶中 | B. | 新制氯水保存在黑色广口瓶中 | ||
| C. | 少量金属钠保存在煤油中 | D. | 氯化亚铁溶液加入少量的铁粉保存 |
20.下列有关说法,不正确的是( )
①形成化学键的过程一定是化学变化
②铁分别与氯气和稀盐酸反应所得的氯化物相同
③为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
④常温下,pH=12的溶液一定能大量存在:K+、Cl-、SO32-、S2-
⑤在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是:范德华力、共价键、共价键.
①形成化学键的过程一定是化学变化
②铁分别与氯气和稀盐酸反应所得的氯化物相同
③为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
④常温下,pH=12的溶液一定能大量存在:K+、Cl-、SO32-、S2-
⑤在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是:范德华力、共价键、共价键.
| A. | ①②③⑤ | B. | ②③④ | C. | ①③④ | D. | ①②④⑤ |
5.下列有关阿伏伽德罗常数(NA)的说法错误的是( )
| A. | 82克O2所含有的原子数目为NA | |
| B. | 0.5molH2O含有的原子数目为1.5NA | |
| C. | 1molH2O含有的H2O分子数目为NA | |
| D. | 0.5NA个氯气分子的物质的量是0.5mol |
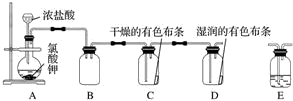
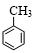 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$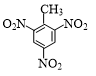 +3H2O.
+3H2O.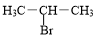 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$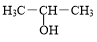 +NaBr.
+NaBr.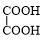 +
+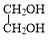 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +2H2O.
+2H2O. Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.