题目内容
15.用NA表示阿伏伽德罗常数,下列叙述正确的是( )| A. | 1molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| B. | 3mol单质Fe与足量水蒸气完全反应,失去9NA个电子 | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 22.4L的Cl2与足量水反应,转移电子数为1NA |
分析 A、铜和浓硫酸反应生成二氧化硫;
B、铁和水蒸气反应后变为+$\frac{8}{3}$价;
C、过氧化钠和水反应制取氧气时,氧元素的价态由-1价变为0价;
D、氯气所处的状态不明确.
解答 解:A、铜和浓硫酸反应生成二氧化硫,而非三氧化硫,故A错误;
B、铁和水蒸气反应后变为+$\frac{8}{3}$价,故3mol铁失去8NA个电子,故B错误;
C、过氧化钠和水反应制取氧气时,氧元素的价态由-1价变为0价,故生成0.1mol氧气时转移0.2NA个电子,故C正确;
D、氯气所处的状态不明确,故其物质的量无法计算,且氯气和水的反应为可逆反应,不能进行彻底,故转移的电子数无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.下列离子方程式正确的是( )
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 碳酸钙与稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 向FeCl3溶液中加入氨水:Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+ |
6.判断以下叙述正确的是CDEF
部分短周期元素的原子半径及主要化合价
A.L2+、R2-的核外电子数相等
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物一定具有两性
D.氢化物的沸点为HnT>HnR
E.T与R形成的TR2、TR3均为共价化合物
F.Q与M的单质均能与盐酸、NaOH溶液反应放出氢气.
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物一定具有两性
D.氢化物的沸点为HnT>HnR
E.T与R形成的TR2、TR3均为共价化合物
F.Q与M的单质均能与盐酸、NaOH溶液反应放出氢气.
3.有机物  可以通过不同的反应得到①
可以通过不同的反应得到①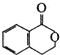 、②
、②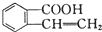 、③
、③ 三种物质.生成这三种有机物的反应类型依次为( )
三种物质.生成这三种有机物的反应类型依次为( )
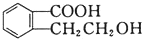 可以通过不同的反应得到①
可以通过不同的反应得到① 、②
、②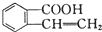 、③
、③ 三种物质.生成这三种有机物的反应类型依次为( )
三种物质.生成这三种有机物的反应类型依次为( )| A. | 酯化、取代、缩聚 | B. | 酯化、消去、缩聚 | C. | 取代、消去、加聚 | D. | 取代、消去、酯化 |
10.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,33.6LCHCl3的分子数为1.5NA | |
| B. | 4.6g乙醇含极性共价键的数目为0.8NA | |
| C. | 4.2g由C2H4和C4H8组成的混合物中含碳原子的数目为0.3NA | |
| D. | 1L0.1mol•L-1的醋酸溶液中含H+数为0.1NA |
20.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 等质量的N2和CO所含分子数均为NA | |
| B. | 在标准状况下,22.4L CH4与18g H2O所含的电子数均为10NA | |
| C. | 一定温度下,1L 1mol•L-1的CH3COONa溶液含NA个CH3COO- | |
| D. | 1mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 |
7.下列各组两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A. | Cu(OH)2和盐酸;Cu(OH)2和CH3COOH | |
| B. | BaCl2和Na2SO4;Ba(OH)2和(NH4)2SO4 | |
| C. | NaHCO3和NaHSO4;Na2CO3和HNO3 | |
| D. | NaHCO3(过量)和Ca(OH)2;Ca(HCO3)2和NaOH(过量) |
13.针对奥运会,国际奥委会提出要承办“绿色奥运”.那么,“绿色化学”在化学工业生产中是指( )
| A. | 在化工厂周围种绿色植物 | |
| B. | 不得排放废水、废气、废渣 | |
| C. | 以绿色植物为原料,用生物催化剂进行化工生产,且原子利用率达到100% | |
| D. | 尽可能减少对环境的污染 |