题目内容
13. 请回答下列问题:
请回答下列问题:(1)31Ga基态原子的核外电子排布式是1s22s22p63s23p63d104s24p1,某种半导体材料由Ga和As两种元素组成,该半导体材料的化学式是GaAs,其晶体结构类型可能为原子晶体.
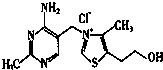
(2)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构式如图所示:以下关于维生素B1的说法正确的是bd.
a.只含σ键和π键
b.既有共价键又有离子键
c.该物质的熔点可能高于NaCl
d.既含有极性键又含有非极性键
(3)维生素B1晶体溶于水的过程中要克服的微粒间的作用力有d.
A.离子键、共价键
B.离子键、氢键、共价键
C.氢键、范德华力
D.离子键、氢键、范德华力.
分析 (1)Ga原子核外电子数为31,根据能量最低原理书写核外电子排布式;Ga是第ⅢA族的金属元素、As是第ⅤA族的非金属元素,二者组成的化合物化学式为GaAs,对应晶体属于原子晶体;
(2)由结构简式知,B1中含有氯离子及另一种有机离子,存在离子键,B1是分子型物质,熔点不可能高于NaCl,同种元素原子之间形成非极性键,不同元素原子之间形成非极性键;
(3)晶体溶于水的过程会电离出Cl-等,故需要克服离子键,B1分子间存在氢键,存在范德华力.
解答 解:(1)Ga原子核外电子数为31,核外电子排布式为:1s22s22p63s23p63d104s24p1,Ga是第ⅢA族的金属元素、As是第ⅤA族的非金属元素,二者组成的化合物化学式为GaAs,对应晶体属于原子晶体,
故答案为:1s22s22p63s23p63d104s24p1;GaAs;原子晶体;
(2)a.由结构简式知,B1中含有氯离子及另一种有机离子,存在离子键,故a错误;
b.B1中含有氯离子及另一种有机离子,存在离子键,其它原子之间形成共价键,故b正确;
c.B1是分子型物质,熔点不可能高于NaCl,故c错误;
d.碳原子之间形成非金属性,N原子与H原子等之间形成极性键,故d正确,
故选:cd;
(3)晶体溶于水的过程会电离出Cl-等,故需要克服离子键,B1分子间存在氢键,存在范德华力,
故选:d.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、化学键等,注意对基础知识的理解掌握.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
15.已知NH4++AlO2-+2H2O=Al(OH)3↓+NH3•H2O,向含有等物质的量的NH4+、Al3+、H+混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,发生以下离子反应:
①H++OH-=H2O
②Al(OH)3+OH-=AlO2-+2H2O
③Al3++3OH-=Al(OH)3↓
④NH4++OH-=NH3•H2O.
先后顺序正确的是( )
①H++OH-=H2O
②Al(OH)3+OH-=AlO2-+2H2O
③Al3++3OH-=Al(OH)3↓
④NH4++OH-=NH3•H2O.
先后顺序正确的是( )
| A. | ①→②→③→④ | B. | ①→③→②→④ | C. | ①→③→④→② | D. | ①→④→②→③ |
1.下列说法正确的是( )
| A. | 100℃时,0.001mol•L-1的NaOH溶液pH=11 | |
| B. | 若溶液中c(H+)与c(OH-)相等,溶液肯定呈中性 | |
| C. | 25℃,0.001mol/LH2SO4溶液中,水电离出的c(OH-)为10-11mol/L | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
8.下列是四种物质的分离实验,已知X与NaOH溶液不反应,则关于X、Y、Z、W所代表的四种物质说法正确的是( )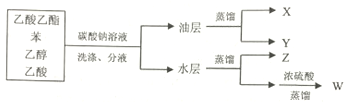

| A. | X是最简单的芳香烃,分子中含有三个碳碳双键 | |
| B. | Y是具有芳香气味的液体,难溶于水,易溶于有机溶剂,能发生水解反应 | |
| C. | Z是无色,有特殊香味的液体,与硫酸混合在140℃可以制备乙烯 | |
| D. | W是有强烈刺激性气味的无色液体,可与氢气发生加成反应,生成Z |
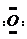 ]2-,CO2的结构式为O=C=O.与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为3s23p1,其中能量最高的电子有1个.
]2-,CO2的结构式为O=C=O.与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为3s23p1,其中能量最高的电子有1个. 碳、氮在自然界中广泛存在.
碳、氮在自然界中广泛存在.

 +NaCl;
+NaCl;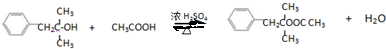 ;
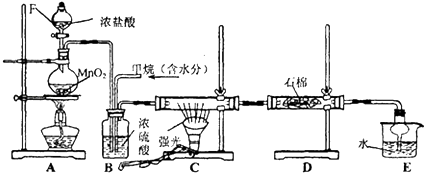
;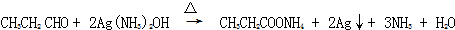 .
.
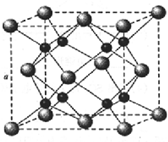 A、B、C、D为原子序数依次增大的四种元素,A原子基态时原子轨道上有两个未成对电子,A2-和B+具有相同的电子层结构;C、D为同周期元素,C元素基态原子核外电子总数是其最外层电子数的3倍;D元素基态原子的最包层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A原子基态时原子轨道上有两个未成对电子,A2-和B+具有相同的电子层结构;C、D为同周期元素,C元素基态原子核外电子总数是其最外层电子数的3倍;D元素基态原子的最包层有一个未成对电子.回答下列问题: