题目内容
14.下列事实中,能说明HNO2是弱电解质的是( )| A. | HNO2溶液用水稀释后,H+浓度下降 | |
| B. | HNO2溶液的导电性比盐酸弱 | |
| C. | HNO2溶液不与氯化钠反应 | |
| D. | 0.lmol•L-1的HNO2溶液的c(H+)=l0-2mol/L |
分析 在溶液中部分电离,即存在电离平衡的电解质属于弱电解质,或根据盐类水解的规律来分析,据此解答.
解答 解:A.HNO2溶液用水稀释后,溶液体积增大,酸的浓度减小,H+浓度下降,不能说明亚硝酸部分电离,故A错误;
B.溶液的导电能力与离子浓度成正比,HNO2溶液的导电性比盐酸弱,只能说明HNO2溶液中离子浓度较小,但不能说明该酸是否完全电离,故B错误;
C.不与氯化钠反应的酸不一定是弱酸,如硝酸,故C错误;
D.0.1mol?L-1亚硝酸溶液的c(H+)为l0-2mol/L,说明亚硝酸部分电离,则为弱电解质,故D正确;
故选D.
点评 本题考查了电解质强弱的判断,根据电解质的电离程度划分,注意电解质强弱与其溶液导电能力、中和反应等都无关,题目难度不大,侧重于考查学生对基础知识的应用能力.

练习册系列答案
相关题目
4.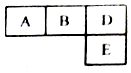 有M、A、B、D、N、E六种短周期元素原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37.下列说法不正确的是( )
有M、A、B、D、N、E六种短周期元素原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37.下列说法不正确的是( )
 有M、A、B、D、N、E六种短周期元素原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37.下列说法不正确的是( )
有M、A、B、D、N、E六种短周期元素原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37.下列说法不正确的是( )| A. | 沸点:M2D>BM3>AM4 | |
| B. | 原子半径:rE>rA>rB>rD | |
| C. | 化合物AnM2n分子中既含有极性鍵又含有非极性鍵 | |
| D. | B元素的氢化物与D元素的单质在一定条件下能发生置换反应,且氧化剂与还原剂的物质的量之比为4:3 |
9.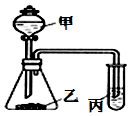 利用如图所示装置,采用适当试剂可完成下表的探究实验,并得出相应的实验结论,其中错误的是( )
利用如图所示装置,采用适当试剂可完成下表的探究实验,并得出相应的实验结论,其中错误的是( )
 利用如图所示装置,采用适当试剂可完成下表的探究实验,并得出相应的实验结论,其中错误的是( )
利用如图所示装置,采用适当试剂可完成下表的探究实验,并得出相应的实验结论,其中错误的是( )| 选项 | 甲 | 乙 | 丙 | 装置丙中的现象 | 实验结论 |
| A | 稀硝酸 | 碳酸钾 | 澄淸石灰水 | 变浑浊 | 酸性:HNO3>H2CO3 |
| B | 稀硫酸 | 碳酸钠 | 次氯酸钙溶液 | 白色沉淀 | 酸性:H2CO3>HClO |
| C | 浓盐酸 | 大理石 | 硅酸钠溶液 | 白色沉淀 | 非金属性:C>Si |
| D | 浓盐酸 | 高锰酸钾 | 石蕊溶液 | 先变红后褪色 | 氯水既有酸性,又具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
19.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )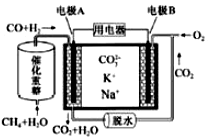

| A. | 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- | |
| B. | 反应CH4+H2O$\frac{\underline{\;催化剂\;}}{△}$3H2+CO,每消耗1molCH4转移12mol 电子 | |
| C. | 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O | |
| D. | 电池工作时,CO32-向电极B移动 |
6.下列说法中正确的是( )
| A. | SO3与SO2分子空间结构不同,分子中S原子杂化方式也不同 | |
| B. | 乙烯分子中的碳氢键是氢原子的1s轨道和碳原子的一个sp3杂化轨道形成的 | |
| C. | 中心原子采取sp3杂化的分子,其几何构型可能是四面体形或三角锥形或V形 | |
| D. | AB2型的分子空间构型必为直线形 |
3.“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次…,价值数倍也”,这里用到的分离方法为( )
| A. | 蒸馏 | B. | 升华 | C. | 萃取 | D. | 蒸发 |
19.对如图两种化合物的结构或性质描述错误的是( )
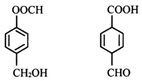

| A. | 均可发生取代、加成反应 | |
| B. | 均能使酸性高锰酸钾溶液褪色 | |
| C. | 分子中共平面的碳原子数相同 | |
| D. | 互为同分异构体,可用NaHCO3溶液鉴别 |