题目内容
关于小苏打水溶液的表述正确的是( )
| A、HCO3-的电离程度大于HCO3-的水解程度 |
| B、c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| C、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| D、存在的电离有:NaHCO3=Na++HCO3-,HCO3-?H++CO32-,H2O?H++OH-,HCO3-+H2O?H2CO3+OH |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:小苏打为碳酸氢钠,碳酸氢钠溶液显示碱性,说明碳酸氢根离子的电离程度小于其水解程度,据此判断A;根据碳酸氢钠溶液中的电荷守恒、物料守恒判断B、C;选项D中,HCO3-+H2O?H2CO3+OH-为碳酸氢根离子的水解方程式.
解答:
解:A.小苏打为碳酸氢镁,因为碳酸氢钠溶液显碱性,所以HCO3-的水解程度大于其电离程度,故A错误;
B.碳酸氢钠溶液中存在物料守恒,根据物料守恒可得:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故B正确;
C.根据碳酸氢钠溶液中的电荷守恒可得:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故C错误;
D.HCO3-+H2O?H2CO3+OH-为水解方程式而不是电离方程式,故D错误;
故选B.
B.碳酸氢钠溶液中存在物料守恒,根据物料守恒可得:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故B正确;
C.根据碳酸氢钠溶液中的电荷守恒可得:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故C错误;
D.HCO3-+H2O?H2CO3+OH-为水解方程式而不是电离方程式,故D错误;
故选B.
点评:本题考查了溶液中离子浓度大小比较、盐酸水解原理及其应用,题目难度中等,注意掌握盐的水解原理及其影响因素,能够根据电荷守恒、物料守恒、盐的水解原理判断溶液中离子浓度大小,选项D为易错点,需要明确电离方程式与水解方程式的区别.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
实验是化学研究的基础.下列实验能达到实验目的是( )
A、 石油的分馏 |
B、 分离硝基苯和水 |
C、 除去甲烷中的乙烯 |
D、 制取并收集乙炔气体 |
不另用任何试剂就能将下列四种溶液:①CuCl2、②NH4Cl、③KCl、④NaOH、鉴别出来,其正确的鉴别顺序是( )
| A、①②④③ | B、④③②① |
| C、①④②③ | D、①②③④ |
下列各溶液中,Na+浓度最大的是( )
| A、0.8L0.4mol/L的NaOH溶液 |
| B、0.2L0.15mol/L的Na3PO4溶液 |
| C、1L0.3mol/L的NaCl溶液 |
| D、4L0.5mol/L的NaCl溶液 |
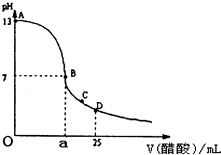 如图为向25mL0.1mol?L-NaOH溶液中逐滴加入0.2mol?L-醋酸溶液过程中溶液pH的变化曲线,请回答:
如图为向25mL0.1mol?L-NaOH溶液中逐滴加入0.2mol?L-醋酸溶液过程中溶液pH的变化曲线,请回答: