题目内容
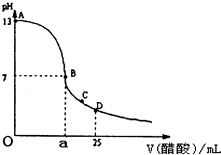 如图为向25mL0.1mol?L-NaOH溶液中逐滴加入0.2mol?L-醋酸溶液过程中溶液pH的变化曲线,请回答:
如图为向25mL0.1mol?L-NaOH溶液中逐滴加入0.2mol?L-醋酸溶液过程中溶液pH的变化曲线,请回答:(1)有人认为B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?
(2)在AB区间内,c(OH-)>c(H-),则c(OH-)与c(CH3COO-)的大小关系是
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)可能大于、小于或等于c(CH3COO-)
(3)在D点时,溶液中c(CH3COO-)+c(CH3COOH)
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)氢氧化钠和醋酸溶液按照物质的量之比1:1反应生成的醋酸钠为强碱弱酸盐,溶液显碱性,pH>7;
(2)在AB区间内,包括醋酸和氢氧化钠恰好完全反应和醋酸不足氢氧化钠溶液过量溶液显碱性两种可能;
(3)在D点时,氢氧化钠溶液和醋酸溶液反应后剩余醋酸,溶液的组成为等浓度的醋酸和醋酸钠的混合物.
(2)在AB区间内,包括醋酸和氢氧化钠恰好完全反应和醋酸不足氢氧化钠溶液过量溶液显碱性两种可能;
(3)在D点时,氢氧化钠溶液和醋酸溶液反应后剩余醋酸,溶液的组成为等浓度的醋酸和醋酸钠的混合物.
解答:
解:(1)溶液混合后发生的反应为:NaOH+CH3COOH=CH3COONa+H20,当醋酸和氢氧化钠的物质的量之比为1:1时,反应生成的CH3COONa为强碱弱酸盐,溶液显碱性,pH>7,介于AB之间,故答案为:否;AB;
(2)在AB区间内,c(OH-)>c(H-),说明溶液显碱性,当氢氧化钠溶液和醋酸恰好反应是时,显碱性,此时生成的溶液可能为醋酸钠,c(OH-)小于c(CH3COO-);当氢氧化钠溶液和醋酸反应后剩余氢氧化钠溶液,溶液仍然显碱性,此时若剩余的氢氧化钠量很大,则c(OH-)大于c(CH3COO-),也有可能剩余的氢氧化钠和醋酸钠中醋酸根水解之后剩余的醋酸根的浓度相等,故答案为:D;
(3)在D点时,反应后醋酸剩余,溶液的组成为等浓度的醋酸和醋酸钠的混合物,根据物料守恒,此时:c(CH3COO-)+c(CH3COOH)=2c(Na+),故答案为:等于.
(2)在AB区间内,c(OH-)>c(H-),说明溶液显碱性,当氢氧化钠溶液和醋酸恰好反应是时,显碱性,此时生成的溶液可能为醋酸钠,c(OH-)小于c(CH3COO-);当氢氧化钠溶液和醋酸反应后剩余氢氧化钠溶液,溶液仍然显碱性,此时若剩余的氢氧化钠量很大,则c(OH-)大于c(CH3COO-),也有可能剩余的氢氧化钠和醋酸钠中醋酸根水解之后剩余的醋酸根的浓度相等,故答案为:D;
(3)在D点时,反应后醋酸剩余,溶液的组成为等浓度的醋酸和醋酸钠的混合物,根据物料守恒,此时:c(CH3COO-)+c(CH3COOH)=2c(Na+),故答案为:等于.
点评:本题是一道有关溶液混合后离子浓度的大小比较问题,难度较大,考查学生分析和解决问题的能力.

练习册系列答案
相关题目
下列叙述中不正确的是( )
| A、溴单质有强氧化性,有毒,所以可用于生产熏蒸剂,杀毒剂 |
| B、液溴应保存在磨口玻璃塞棕色细口试剂瓶中,并加少量水进行水封 |
| C、碘易溶于酒精,所以能用酒精从碘水中将碘萃取出来 |
| D、用加热的方法可将碘中混有的少量沙子除去 |
 实验室用MnO2与浓HCl反应制Cl2,若用如图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属镁粉的反应.每个虚线框表示一个单元装置,其中错误的是( )
实验室用MnO2与浓HCl反应制Cl2,若用如图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属镁粉的反应.每个虚线框表示一个单元装置,其中错误的是( )| A、只有①和②处 |
| B、只有②处 |
| C、只有①、②和③处 |
| D、①、②、③、④处 |
关于小苏打水溶液的表述正确的是( )
| A、HCO3-的电离程度大于HCO3-的水解程度 |
| B、c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| C、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| D、存在的电离有:NaHCO3=Na++HCO3-,HCO3-?H++CO32-,H2O?H++OH-,HCO3-+H2O?H2CO3+OH |
下列糖类属于还原性糖的是( )
| A、蔗糖 | B、葡萄糖 |
| C、纤维素 | D、淀粉 |
下列有关说法正确的是( )
| A、Na2O2能与水反应,所以Na2O2可以作气体的干燥剂 |
| B、溴化银具有感光性,碘化银不具有感光性,但AgI可用于人工降雨 |
| C、碘易溶于酒精,所以可用酒精从碘水中萃取碘单质 |
| D、钠很活泼,故钠应保存在石蜡或煤油中 |
 (1)稀释0.1mol?L-1氨水时,随着水量的增加而减小的是
(1)稀释0.1mol?L-1氨水时,随着水量的增加而减小的是