题目内容
4.FeCl2能否通过化合反应来制取,若不能,写出不能制备的理由;若能,写出反应的化学方程式2FeCl3+Fe=3FeCl2.分析 氯化铁为+3价,能够与铁发生氧化还原反应生成氯化亚铁,据此解答.
解答 解:氯化铁与铁发生化合反应生成氯化亚铁,方程式:2FeCl3+Fe=3FeCl2;
故答案为:2FeCl3+Fe=3FeCl2.
点评 本题考查了反应类型判断,明确不同价态铁之间转化是解题关键,题目难度不大.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
14.完全皂化后得到甘油和高级脂肪酸钠的混合溶液,若要使高级脂肪酸钠和甘油溶液分离,可以采用的方法是( )
| A. | 渗析 | B. | 分液 | C. | 蒸馏 | D. | 盐析 |
15.下列反应中,反应物中各元素都参加氧化还原反应的是( )
| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | B. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | ||
| C. | 2H2S+SO2=3S+2H2O | D. | Cl2+2NaOH=NaCl+NaClO+H2O |
16.有四种短周期元素,它们的结构、性质等信息如下表所述:
请根据表中信息填写:
(1)A原子的核外电子排布式为1s22s22p63s1.
(2)B元素在周期表中的位置为第3周期ⅢA族;离子半径:B小于A(填“大于”或“小于”).
(3)C原子的电子排布图是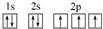 ,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈哑铃形.
,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈哑铃形.
(4)D原子的电子排布式为1s22s22p63s23p5或[Ne]3s23p5,D-的结构示意图是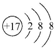 .
.
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
(1)A原子的核外电子排布式为1s22s22p63s1.
(2)B元素在周期表中的位置为第3周期ⅢA族;离子半径:B小于A(填“大于”或“小于”).
(3)C原子的电子排布图是
 ,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈哑铃形.
,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈哑铃形.(4)D原子的电子排布式为1s22s22p63s23p5或[Ne]3s23p5,D-的结构示意图是
 .
.
13.非金属性最强的元素是( )
| A. | F | B. | C | C. | S | D. | O |
14.下列说法中不正确的是( )
| A. | 分子式为C4H10O并能与金属钠反应放出氢气的有机化合物有5种 | |
| B. | 反应2H2(g)+O2(g)═2H2O(l)变化过程中,熵在减小(即△S<O) | |
| C. | 乙烯和1,3-丁二烯的混合气体1 L,催化剂存在下与足量氢气发生加成反应,消耗1.4 L氢气,则原混合气体中乙烯和1,3-丁二烯的体积比为:3:2 | |
| D. | 可用氢氧化钠溶液、银氨溶液和碘水检验淀粉溶液是否是部分发生水解 |
 .
.
 .
.
 ,反应类型为水解(取代)反应.
,反应类型为水解(取代)反应. ,反应类型为酯化(取代)反应.
,反应类型为酯化(取代)反应.