题目内容
19.NA为阿伏伽德罗常数,下列说法正确的是( )| A. | 标准状况下,11.21的己烷所含的分子数为0.5 NA | |
| B. | 28g乙烯所含共用电子对数目为4 NA | |
| C. | 1mol苯乙烯中含有的C=C数为4NA | |
| D. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
分析 A.标况下,己烷为液体;
B.乙烯分子中含有1个碳碳双键、4个碳氢键,总共含有6个共用电子对;
C.苯分子中不含有碳碳双键;
D.质量换算物质的量,结合乙烯和丙烯最简式相同为CH2,只需计算2.8gCH2中含的碳原子数.
解答 解:A.标况下,己烷为液体,不能使用气体摩尔体积,故A错误;
B.28g乙烯的物质的量为1mol,1mol乙烯中含有2mol碳碳共用电子对、4mol碳氢共用电子对,总共含有6mol共用电子对,所含共用电子对数目为6NA,故B错误;
C.1mol苯乙烯中含有的C=C数为1NA,故C错误;
D.乙烯和丙烯最简式相同为CH2,只需计算2.8gCH2中含的碳原子数,2.8gCH2中含的碳原子数=$\frac{2.8g}{14g/mol}$×NA=0.2NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的应用,主要考查气体摩尔体积的条件应用,质量换算物质的量计算微粒数,化学键数的方法与判断,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列物质的名称正确的是( )
| A. |  异戊烷 异戊烷 | B. | 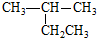 2-甲基丁烷 2-甲基丁烷 | C. |  间二甲苯 间二甲苯 | D. |  2-甲基-4-丁醇 |
10.下列化学方程式或离子方程式正的( )
| A. | 乙酸与碳酸钠溶液反应的离子方程式:2H++CO32-═CO2↑+H2O | |
| B. | 苯酚钠溶液中通入少量二氧化碳的离子方程式:2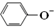 +H2O+CO2→2 +H2O+CO2→2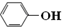 +CO32- +CO32- | |
| C. | 丙烯聚合成聚丙烯的化学方程式:nCH2=CHCH3$\stackrel{催化剂}{→}$  | |
| D. | 乙醛溶液与足量的银氨溶液共热的化学方程式:CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag↓+3NH3+H2O? |
7.利用原电池原理可以探究金属的活动性.
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计.锌片做负极(填“正”或“负”),银片上发生的电极反应式是2H++2e-=H2↑.
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g.此时产生标准状况下氢气的体积为4.48L,通过导线的电子的物质的量为0.4mol.
(3)为证明铁的金属活动性比铜强,某同学设计了如下一些方案.其中能证明铁的金属活动性比铜强的方案是①③④.(填序号)
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计.锌片做负极(填“正”或“负”),银片上发生的电极反应式是2H++2e-=H2↑.
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g.此时产生标准状况下氢气的体积为4.48L,通过导线的电子的物质的量为0.4mol.
(3)为证明铁的金属活动性比铜强,某同学设计了如下一些方案.其中能证明铁的金属活动性比铜强的方案是①③④.(填序号)
| 方 案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡产生,铜片上无气泡产生 |
| ④将铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |
14.根据图1、图2、图3及题中信息,回答下列问题

(1)图1是锌锰干电池基本构造图,该电池的负极材料是Zn;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是2NH4++2e-═2NH3↑+H2↑;当电路中每通过0.2mole-,负极质量减少6.5g;
(2)图2是利用废旧锌锰干电池内的黑色糊状物分离得到黑色残渣MnO2的流程图.该流程中溶解和过滤操作均要使用到的玻璃仪器有烧杯和玻璃棒;
(3)图3是探究MnO2在制O2过程中的作用的实验装置图,利用该装置完成下表中实验一和实验二,实验过程中有关实验现象和所得数据如下表(已知:两次实验气体的体积在相同条件下测定:H2O2由分液漏斗滴入到圆底烧瓶).
③在测量气体体积时,除要注意待气体温度恢复至室温、平视度数外,还需要注意上下移动B管,使A、B两管中液面相平;
④实验一、二中参加反应的H2O2的物质的量之比为2:1.

(1)图1是锌锰干电池基本构造图,该电池的负极材料是Zn;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是2NH4++2e-═2NH3↑+H2↑;当电路中每通过0.2mole-,负极质量减少6.5g;
(2)图2是利用废旧锌锰干电池内的黑色糊状物分离得到黑色残渣MnO2的流程图.该流程中溶解和过滤操作均要使用到的玻璃仪器有烧杯和玻璃棒;
(3)图3是探究MnO2在制O2过程中的作用的实验装置图,利用该装置完成下表中实验一和实验二,实验过程中有关实验现象和所得数据如下表(已知:两次实验气体的体积在相同条件下测定:H2O2由分液漏斗滴入到圆底烧瓶).
| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论 |
| 实验一 | 足量MnO2 | a.充分反应后未见黑色固体物质减少 b.收集到112mL气体 | ①催化剂 |
| 实验二 | 足量MnO2和稀硫酸 | c.充分反应后黑色粉末部分溶解 d.收集到112mL气体 | ②氧化剂 |
④实验一、二中参加反应的H2O2的物质的量之比为2:1.
6.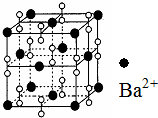 钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如图所示,有关说法正确的是( )
钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如图所示,有关说法正确的是( )
 钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如图所示,有关说法正确的是( )
钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如图所示,有关说法正确的是( )| A. | 该晶体为分子晶体 | |
| B. | 晶体的化学式为Ba2O2 | |
| C. | 该氧化物的电子式为 | |
| D. | 与每个Ba2+距离相等且最近的Ba2+共有6个 |
3.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1的硫化钠溶液中:c(OH-)═c(H+)+c(HS-)+c (H2S) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) | |
| D. | 0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合:c(HCN)+c(CN-)═2 c(Na+) |