题目内容
6.下列实验现象描述不正确的是( )| 选项 | 实验 | 现象 |
| A | 加热放在坩埚中的小钠块 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着 |
| C | 在含有酚酞的水中加入一小块钠 | 钠浮在水面上,四处游动,发出嘶嘶响声,溶液变红 |
| D | 在空气中久置的铝条放入稀硫酸溶液中 | 立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.钠的熔点低,燃烧时先熔化,后燃烧生成淡黄色固体;
B.氧化铝的熔点高,包裹在Al的外面;
C.钠的密度比水的密度小,与水反应生成NaOH和氢气;
D.空气中久置的铝条,表面有氧化铝,氧化铝先与硫酸反应.
解答 解:A.钠的熔点低,燃烧时先熔化,后燃烧生成淡黄色固体,则观察到钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体,故A正确;
B.氧化铝的熔点高,包裹在Al的外面,则观察到铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着,故B正确;
C.钠的密度比水的密度小,与水反应生成NaOH和氢气,则观察到钠浮在水面上,四处游动,发出嘶嘶响声,溶液变红,故C正确;
D.空气中久置的铝条,表面有氧化铝,氧化铝先与硫酸反应,不能立即产生气体,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应和现象为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
20.下列事实不能用勒夏特列原理解释的是( )
| A. | 工业合成氨中,将氨气液化分离以提高氨气产率 | |
| B. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 两支试管中分别加入等体积5%的H3O2溶液,在其中一支试管中加入2~3滴FeCl3溶液,该试管中产生气泡快 |
17.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 31.6 g高锰酸钾完全分解产生O2的体积约为2.24 L | |
| B. | 在25℃、101KPa时,24.5L氨气所含质子数约为10NA | |
| C. | 0.3 mol•L-1硫酸钠溶液中所含Na+和SO42-总物质的量为0.9 mol | |
| D. | 25℃、101KPa下,2.24 L二氧化碳与二氧化硫的混合气体中所含氧原子数约为0.2NA |
1.下列说法中正确的是( )
| A. | 标准状况下,32 g O2占有的体积约为22.4 L | |
| B. | 氢气的摩尔质量是2g | |
| C. | 在标准状况下,22.4 L水的质量为18 g | |
| D. | 1molH2O的质量是18g/mol |
11.下列各组物质中,所含分子数一定相同的是( )
| A. | lgH2 和 8gO2 | |
| B. | 150℃、1.01×105Pa 时,18LH2O和 18LCO2 | |
| C. | 0.1 molHCl和2.24LHe | |
| D. | 标准状况下,2.24LCCl4和6.02×1022个CO分子 |
18.物质的量相等的Na、Mg、Al分别跟足量稀H2SO4反应,产生的氢气的物质的量之比为( )
| A. | 1:1:1 | B. | 1:2:3 | C. | 1:3:3 | D. | 3:2:1 |
15.下列做法一定能增加化学反应速率的是( )
| A. | 增大压强 | B. | 使用合适的催化剂 | ||
| C. | 增多反应物的用量 | D. | 增大反应的温度 |
16.阿斯巴甜是目前使用最广泛的甜味剂.甜度约为蔗糖的200倍,其结构简式为:
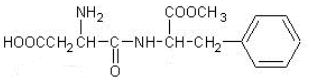
下列关于阿斯巴甜的说法正确的是( )

下列关于阿斯巴甜的说法正确的是( )
| A. | 分子式为C14H19N2O5 | B. | 既能与酸反应又能与碱反应 | ||
| C. | 不能发生水解反应 | D. | 1mol该物质最多可与2molNaOH反应 |