题目内容
14.镭元素位于元素周期表第七周期ⅡA族.下列关于镭的性质的说法不正确的是( )| A. | 氢氧化物呈两性 | B. | 单质与水反应放出氢气 | ||
| C. | 在化合物中呈+2价 | D. | 单质的还原性比镁强 |
分析 镭是元素周期表中第七周期的ⅡA族元素,最外层有2个电子,性质活泼,易与水反应,利用同主族元素性质的递变规律以及同主族元素性质具有相似性分析,可以结合熟悉的金属镁、钙和钡的性质来回答.
解答 解:A、同主族从上到下,金属性逐渐增强,最高价氧化物对应水化物的碱性增强,氢氧化钡是强碱,所以镭的氢氧化物是强碱,故A错误;
B.同主族元素从上到下金属性逐渐增强,镭的金属性较强,单质性质活泼,与水反应放出氢气,故B正确;
C.镭最外层有2个电子,在化合物中呈+2价,故C正确;
D.同周期从上往下金属性增强,所以单质的还原性比镁强,故D正确;
故选A.
点评 本题考查同主族元素的性质的递变规律,从同主族元素金属性对应单质、化合物的性质的相似性和递变性的角度解答该题,难度不大,注意元素的金属性和非金属性的递变规律.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.下列所示的实验,能达到实验目的是( )
| A | B | C | D |
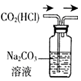 | 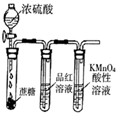 | 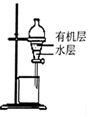 | 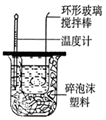 |
| 除去CO2中含有的少量HCl气体 | 说明浓H2SO4具有脱水性,强氧化性,SO2具有漂白性、还原性 | 将有机层从分液漏斗下口放出 | 用于中和反应反应热的测定 |
| A. | A | B. | B | C. | C | D. | D |
5.下列几种化合物 ①NaHCO3 ②Al(OH)3 ③NaAlO2 ④Al2O3⑤AlCl3既能跟盐酸反应,又能跟NaOH溶液反应的是( )
| A. | ②③ | B. | ①②④ | C. | ②③⑤ | D. | 全部 |
2.下列说法中不正确的是( )
①核外电子总数相同的微粒元素种类一定相同
②同位素的化学性质基本相同
③质子数相同、电子数也相同的两种微粒,不可能是一种分子和一种离子
④元素的相对原子质量取整数,就是其质量数
⑤金属氧化物可以是酸性氧化物
⑥非极性键只存在于单质中,极性键只存在于化合物中
⑦离子化合物只含离子键
⑧共价化合物不含离子键.
①核外电子总数相同的微粒元素种类一定相同
②同位素的化学性质基本相同
③质子数相同、电子数也相同的两种微粒,不可能是一种分子和一种离子
④元素的相对原子质量取整数,就是其质量数
⑤金属氧化物可以是酸性氧化物
⑥非极性键只存在于单质中,极性键只存在于化合物中
⑦离子化合物只含离子键
⑧共价化合物不含离子键.
| A. | ①④⑥⑦ | B. | ③④⑥⑦ | C. | ①②④⑥⑦ | D. | ①②⑥⑦ |
9.反应A(g)+3B(g)═2C(g)+D(g)在四种不同情况下的反应速率分别为:
①v(A)=9mol/(L•min)
②v(B)=0.6mol/(L•s)
③v(C)=30mol/(L•min)
④v (D)=0.45mol/(L•s)
则反应进行由快到慢的顺序为( )
①v(A)=9mol/(L•min)
②v(B)=0.6mol/(L•s)
③v(C)=30mol/(L•min)
④v (D)=0.45mol/(L•s)
则反应进行由快到慢的顺序为( )
| A. | ④>③>②>① | B. | ④>③>①>② | C. | ②>③>④>① | D. | ②>④>③>① |
19.已知H2A为二元弱酸,室温时,配制一组c(H2A)+c(HA-)+c(A2-)=0.100mol•L-1的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示,下列指定溶液中微粒的物质的量浓度关系不正确的是( )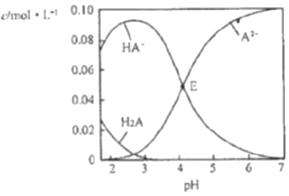

| A. | pH=2的溶液中:c(H2A)+c(A2-)>c(HA-) | |
| B. | E点溶液中:c(Na+)-c(HA-)<0.100mol•L-1 | |
| C. | c(Na+)=0.100mol•L-1的溶液中:c(H+)+c(H2A)=c(OH-)+c(A2-) | |
| D. | pH=7的溶液中:c(Na+)>2c(A2-) |
4.下列反应表示氮的固定作用的是( )
| A. | N2与H2在一定条件下合成NH3 | B. | NH3经催化氧化生成NO | ||
| C. | NO和O2反应生成NO2 | D. | 由NH3制碳铵和尿素 |
 有X、Y、Z、W四种短周期元素,它们的核电荷数依次增大.只有Z是金属元素,X最外层只有一个电子,Y和W元素原子的最外层电子数相同,且Y元素原子L 层电子数是K层电子数的3倍,Z元素原子的最外层电子数是W元素原子最外层电子数的一半.请回答:
有X、Y、Z、W四种短周期元素,它们的核电荷数依次增大.只有Z是金属元素,X最外层只有一个电子,Y和W元素原子的最外层电子数相同,且Y元素原子L 层电子数是K层电子数的3倍,Z元素原子的最外层电子数是W元素原子最外层电子数的一半.请回答: .
.