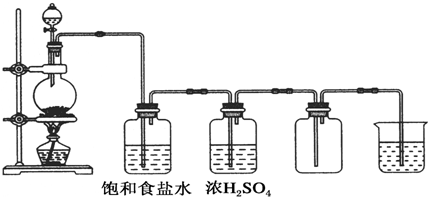
题目内容
2.实验室有下列试剂:①NaOH溶液、②水玻璃、③Na2S溶液、④Na2CO3溶液、⑤NH4Cl溶液、⑥澄清石灰水、⑦浓硫酸,其中必须用带橡胶塞的试剂瓶保存的是( )| A. | ①⑥ | B. | ①②③④⑥ | C. | ①②③⑥ | D. | ①②③④⑦ |
分析 玻璃中含有二氧化硅,只要能和二氧化硅反应的药品不能盛放在带有玻璃塞的试剂瓶中,据此分析解答.
解答 解:①NaOH与二氧化硅反应生成粘性的硅酸钠,导致玻璃塞和试剂瓶粘结在一起而打不开,所以氢氧化钠溶液需放在带橡胶塞的玻璃试剂瓶中;
②Na2SiO3溶液由于弱酸阴离子水解导致溶液显示碱性,可以和玻璃的成分二氧化硅之间反应,所以盛放Na2SiO3等溶液的试剂瓶应用橡皮塞;
③Na2S水解显碱性,与二氧化硅反应,所以Na2S需放在带橡胶塞的玻璃试剂瓶中;
④Na2CO3水解显碱性,与二氧化硅反应硅酸钠和水,所以Na2CO3需放在带橡胶塞的玻璃试剂瓶中;
⑤NH4Cl溶液弱碱阳离子水解导致溶液显示酸性,酸性溶液与玻璃成分不反应,可以存放在玻璃塞的试剂瓶中;
⑥石灰水与二氧化硅反应硅酸钙和水,所以石灰水需放在带橡胶塞的玻璃试剂瓶中;
⑦浓H2SO4溶液显示酸性,酸性溶液与玻璃成分不反应,可以存放在玻璃塞的试剂瓶中.
故选B.
点评 本题主要考查的是试剂的存放以及盐类水解原理的应用,题目难度中等,侧重对学生灵活运用基础知识解决实际问题的能力的培养.

练习册系列答案
相关题目
10.同周期的X、Y、Z三元素,其最高价氧化物水化物的酸性由弱到强的顺序是:H3ZO4<H2YO4<HXO4,则下列判断正确的是( )
| A. | 原子半径 X>Y>Z | |
| B. | 非金属性 X>Y>Z | |
| C. | X、Y、Z的单质与氢气化合能力由弱到强 | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序由弱到强 |
17.下列关于能量转换的认识不正确的是( )
| A. | 手机电池在充电时,电能转变为化学能 | |
| B. | 绿色植物进行光合作用时,太阳能主要转化为化学能 | |
| C. | 煤燃烧时,化学能主要转化为热能 | |
| D. | 白炽灯工作时,电能全部转化为光能 |
7.下列化合物不能用相应元素的单质直接化合而成的是( )
①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S ⑥FeCl2 ⑦FeCl3.
①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S ⑥FeCl2 ⑦FeCl3.
| A. | ②⑤ | B. | ①④⑥ | C. | ③④ | D. | ④⑥⑦ |
11.某元素的原子核外有三个电子层,其最外层电子数是内层电子总数的一半,则此元素是( )
| A. | Si | B. | P | C. | S | D. | Cl |
12.为了探究外界条件对过氧化氢分解速率的影响,某化学兴趣小组的同学做了以下实验.
请回答下列问题:
(1)过氧化氢分解的化学方程式为2H2O2$\frac{\underline{\;氯化铁\;}}{\;}$2H2O+O2↑.
(2)实验①的目的是究温度对H2O2分解速率的影响;.
(3)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率(用实验中所提供的几种试剂).
(4)某同学在50mL一定浓度的H2O2溶液中加入适量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图1所示,则A、B、C三点所表示的瞬时反应速率最慢的是C(填字母代号).
(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,该兴趣化学小组的同学分别设计了如图2、3所示的实验.请回答相关问题:
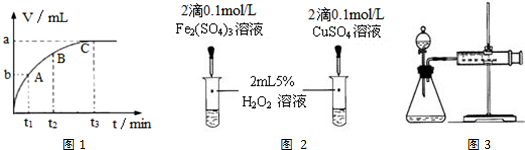
①定性分析:如图2可通过观溶液中气泡产生的速率,定性比较得出结论;该实验中将FeCl3溶液改为Fe2(SO4)3溶液的原因是排除氯离子的干扰.
②定量分析:用图3所示装置做对照试验,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.实验中需要测量的数据是在同温同压下,收集40mL气体所需的时间.
(6)通过对上述实验过程的分析,在实验设计时,要考虑控制变量(或对比)方法的应用.
请回答下列问题:
| 编号 | 实验操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL5%H2O2溶液,各滴入3滴 1mol/LFeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增多. |
| ② | 另取两支试管分别加入5mL5%H2O2溶液和5mL10%H2O2 溶液 | 两支试管中均未明显见到有 气泡产生. |
(2)实验①的目的是究温度对H2O2分解速率的影响;.
(3)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率(用实验中所提供的几种试剂).
(4)某同学在50mL一定浓度的H2O2溶液中加入适量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图1所示,则A、B、C三点所表示的瞬时反应速率最慢的是C(填字母代号).
(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,该兴趣化学小组的同学分别设计了如图2、3所示的实验.请回答相关问题:

①定性分析:如图2可通过观溶液中气泡产生的速率,定性比较得出结论;该实验中将FeCl3溶液改为Fe2(SO4)3溶液的原因是排除氯离子的干扰.
②定量分析:用图3所示装置做对照试验,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.实验中需要测量的数据是在同温同压下,收集40mL气体所需的时间.
(6)通过对上述实验过程的分析,在实验设计时,要考虑控制变量(或对比)方法的应用.
 现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料,也是一种家庭常见饮品的主要成分.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.G2E是红色固体.请回答下列问题:
现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料,也是一种家庭常见饮品的主要成分.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.G2E是红色固体.请回答下列问题: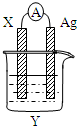 依据氧化还原反应2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.回答下列问题.
依据氧化还原反应2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.回答下列问题.