题目内容
15.在一个密闭容器中,有甲、乙、丙、丁四种物质在一定条件下充分反应,测得反应前后各物质质量如表,则该密闭容器中发生的化学反应类型为分解反应.| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 5 | 5 | 55 | 5 |
| 反应后质量/g | 27 | 待测 | 0 | 19 |
分析 由表格数据可知,甲、丁的质量增加,为生成物,丙的质量减少,且55>(27-5)+(19-5),结合质量守恒定律来解答.
解答 解:由表格数据可知,甲、丁的质量增加,为生成物,丙的质量减少,且55>(27-5)+(19-5),由质量守恒可知,乙为生成物,即丙分解生成甲、乙、丁,属于分解反应,故答案为:分解反应.
点评 本题考查基本反应类型的判断,为高频考点,把握表格数据及质量守恒定律为解答的关键,侧重分析与应用能力的考查,注意质量的变化,题目难度不大.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
5.在20℃时一刚性容器内部有一不漏气且可滑动的活塞将容器分隔成左、右室两室.左室充入N2,右室充入H2和O2,活塞正好停留离左端$\frac{1}{5}$处(如图a)然后点燃引爆H2和O2混合器,活塞先左弹(设容器不漏气),恢复至原来温度,活塞恰好停在中间(如图b),水蒸气的体积可忽略,则反应前H2和O2的体积比可能是( )

| A. | 3:1 | B. | 1:3 | C. | 2:1 | D. | 7:1 |
3.针对下面10种元素,完成以下各小题.
(1)地壳中含量最多的元素是氧(或氧元素)(填名称).
(2)最高价氧化物对应的水化物碱性最强的是NaOH(填化学式).
(3)Al的原子结构示意图为 .
.
(4)S和Cl相比,元素非金属性较强的是Cl.
(5)可用来制造光导纤维的物质是二氧化硅(或SiO2),晶体硅的主要用途是制造半导体材料(写出一种).
(6)工业上以N2和H2为原料,在高温、高压和催化剂存在的条件下制备NH3,请写出反应的化学方程式:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)最高价氧化物对应的水化物碱性最强的是NaOH(填化学式).
(3)Al的原子结构示意图为
 .
.(4)S和Cl相比,元素非金属性较强的是Cl.
(5)可用来制造光导纤维的物质是二氧化硅(或SiO2),晶体硅的主要用途是制造半导体材料(写出一种).
(6)工业上以N2和H2为原料,在高温、高压和催化剂存在的条件下制备NH3,请写出反应的化学方程式:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
10.下列化合物的核磁共振氢谱中出现三个峰的是( )
| A. | 2,5-二甲基己烷 | B. | 2,2-二甲基丙烷 | ||
| C. | 2,6-二甲基庚烷 | D. | 2,2,3,3-四甲基丁烷 |


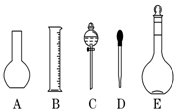 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题: eSO4+Cu B.3CO+Fe2O3
eSO4+Cu B.3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑