题目内容
18.下列叙述正确的是( )| A. | 酸性氧化物不一定都是非金属氧化物 | |
| B. | HCl、H2S、NH3都是电解质 | |
| C. | 强酸强碱都是离子化合物 | |
| D. | FeBr3、FeCl2、CuS都不能直接用化合反应制备 |
分析 A、酸性氧化物不一定是非金属氧化物;
B、电解质是在水溶液或是熔融状态下能导电的化合物;
C、离子化合物是阴阳离子组成的化合物;
D、根据单质的氧化性强弱确定金属被氧化到的价态.
解答 解:A、酸性氧化物不一定都是非金属氧化物,如高锰酸酐Mn2O7就属于酸性氧化物,故A正确;
B、HCl都是电解质,但是H2S、NH3是非电解质,故B错误;
C、HCl是强酸,属于共价化合物,故C错误;
D、FeCl2可以用金属铁和氯化铁之间的化合反应来制备,故D错误.
故选A.
点评 本题考查学生物质的分类以及元素化合物的性质知识,属于综合知识的考查,难度不大.

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
8.在恒温、恒容的条件下,有反应2A(g)+2B(g)?C(g)+3D(g),现从两条途径分别建立平衡.途径Ⅰ:A、B的起始浓度均为2mol•L-1,C、D的起始浓度为0;途径Ⅱ:C、D的起始浓度为2mol•L-1和6mol•L-1,A、B的起始浓度为0.则以下叙述正确的是( )
| A. | 两途径最终达到平衡时,体系内混合气体的百分组成相同 | |
| B. | 两途径最终达到平衡时,体系内混合气体的百分组成不同 | |
| C. | 途径Ⅰ到达平衡所用时间一定等于途径Ⅱ到达平衡所用时间 | |
| D. | 达平衡时,途径Ⅰ所得混合气体的密度等于途径Ⅱ所得混合气密度的一半 |
9.已知室温时,0.1mol•L-1某一元酸HA在水中有0.01%发生电离,下列叙述正确的是( )
| A. | 该溶液的PH=4 | |
| B. | 升高温度,溶液的PH增大 | |
| C. | 稀释时溶液中所有离子的浓度都减少 | |
| D. | 此酸的电离平衡常数约为1×10-9 |
6.某无色透明溶液,在酸性环境下能大量共存的离子组是( )
| A. | CH3COO-、Cl-、NH4+、SO42- | B. | Mg2+、Cl-、Na+、NO3- | ||
| C. | K+、MnO4-、NO3-、Fe2+ | D. | Na+、SO42-、HCO3-、Cl- |
13.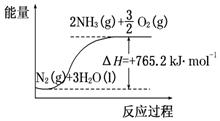 一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
请回答下列问题:
(1)50℃时从开始到3h内以O2物质的量变化表示的平均反应速率为1.5×10-6 mol•h-1.
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是:N2(g)+3H2O(l)=2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.2kJ•mol-1.
 一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
(1)50℃时从开始到3h内以O2物质的量变化表示的平均反应速率为1.5×10-6 mol•h-1.
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是:N2(g)+3H2O(l)=2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.2kJ•mol-1.
3.干冰是( )
①单质;②混合物;③化合物;④纯净物;⑤氧化物.
①单质;②混合物;③化合物;④纯净物;⑤氧化物.
| A. | ①②③ | B. | ②③④⑤ | C. | ①③⑤ | D. | ③④⑤ |
10.在一定条件下,PbO2 与Cr3+反应,产物是Cr2O72-和Pb2+,则与5molCr3+反应所需PbO2的物质的量为( )
| A. | 7.5mol | B. | 1.5mol | C. | 3mol | D. | 3.25mol |
5.一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?xC(g)△H<0,B、C的物质的量随时间变化的关系如图一,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图二.
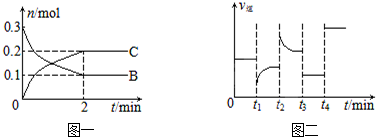
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | t2时改变的条件可能是增大c(C),平衡时B的物质的量分数增大 | |
| B. | t1时改变的条件是降温,平衡逆向移动 | |
| C. | t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变 | |
| D. | x=2,反应开始2 min内,v(B)=0.1 mol/(L•min) |