题目内容
11.X、Y、Z、W为四种短周期非金属元素,其中X单质是一种重要的半导体材料,X、Y、Z同周期,且原子序数依次增大,Y、W同主族,离子半径Y2->W2-. 下列说法正确的是( )| A. | X和W组成的化合物属于分子晶体 | |
| B. | Y的气态氢化物比Z的气态氢化物稳定 | |
| C. | X的单质既能与NaOH溶液反应,又能与氢氟酸反应 | |
| D. | 向KI-淀粉溶液中通入某气体后变蓝,则该气体一定是Z的单质 |
分析 X、Y、Z、W为四种短周期非金属元素,其中X单质是一种重要的半导体材料,则X为Si;X、Y、Z同周期,即处于第三周期,且原子序数依次增大,Y、W同主族,离子半径Y2->W2-,结合离子所带电荷,可推知Y为S、W为O;Z的原子序数对应S,故Z为Cl,据此进行解答.
解答 解:X、Y、Z、W为四种短周期非金属元素,其中X单质是一种重要的半导体材料,则X为Si,X、Y、Z同周期,即处于第三周期,且原子序数依次增大,Y、W同主族,离子半径Y2->W2-,结合离子所带电荷,可推知Y为S、W为O,故Z为Cl,
A.X为Si、W为O,二者形成的化合物为二氧化硅,二氧化硅为原子晶体,故A错误;
B.Y为S、Z为Cl,非金属性S<Cl,故氢化物稳定性:H2S<HCl,故B错误;
C.X为Si,硅单质能够与氢氧化钠溶液反应生成硅酸钠和氢气,也能够与氟化氢反应生成四氯化硅,故C正确;
D.向碘化钾溶液中加入某气体后溶液变蓝,说明该气体具有氧化性,可以是氯气、臭氧等,但不等于为氯气,故D错误;
故选C.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,推断元素是解题关键,注意熟练掌握原子结构与元素周期律的关系,D选项为易错点,注意具有氧化性的气体不一定为氯气,还可能为臭氧等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只分析图形不能得出的结论是( )
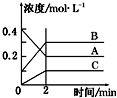

| A. | A是反应物 | |
| B. | 前2 min A的分解速率为0.1 mol•L-1•min-1 | |
| C. | 达平衡后,若升高温度,平衡向正反应方向移动 | |
| D. | 反应的方程式为:2A(g)?2B(g)+C(g) |
6.某药物分子结构简式如图所示,下列关于该物质的说法不正确的是( )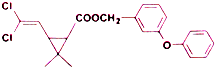

| A. | 分子式为C21H20O3Cl2 | |
| B. | 醚键上的氧原子至少与另外11个原子共面 | |
| C. | 分子中不存在手性碳原子 | |
| D. | 在一定条件下可发生加成、取代、氧化反应 |
16.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H1=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g);△H2=-192.9kJ•mol-1
下列说法正确的是( )
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H1=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g);△H2=-192.9kJ•mol-1
下列说法正确的是( )
| A. | CH3OH的燃烧热△H=-192.9 kJ•mol-1 | |
| B. |  ②中的能量变化如图所示,则△H2=E1-E3 ②中的能量变化如图所示,则△H2=E1-E3 | |
| C. | H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收热量 | |
| D. | 根据②推知:在25℃,101 kPa时,1 molCH3OH(g)完全燃烧生成CO2和H2O放出的热量应大于192.9 kJ |
3.具备基本的化学实验技能是进行科学探究的基础和保证.下列有关实验操作正确的是( )
| A. |  给液体加热 | B. | 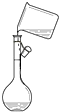 转移溶液 | C. | 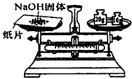 称取NaOH固体 | D. |  量取液体 |
1.常温常压下,24ml氢气和氧气的混合气体,点燃反应后再恢复到原来温度和压强.剩余气体体积为3ml,则原混合气体中氢气与氧气的分子个数比可能是( )
| A. | 1:16 | B. | 16:1 | C. | 17:7 | D. | 5:7 |
 .CaC2晶胞结构与氯化钠晶体相似,则在晶体中与钙离子距离最近的C22-数目为6,这些C22-在空间所围成的几何图形为正八面体
.CaC2晶胞结构与氯化钠晶体相似,则在晶体中与钙离子距离最近的C22-数目为6,这些C22-在空间所围成的几何图形为正八面体 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.其中A原子所处的周期数、族序数都与其原子序数相等.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18 列中的第7列元素.D的原子序数比E小5,D跟B可形成离化合物其晶胞结构如图.
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.其中A原子所处的周期数、族序数都与其原子序数相等.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18 列中的第7列元素.D的原子序数比E小5,D跟B可形成离化合物其晶胞结构如图.